Ngày 29.12.2023, hội thảo chuyên ngành thẩm mỹ với chủ đề cập nhật các xu hướng căng bóng, chống lão hóa, trẻ hóa, trị...
Mụn viêm thường do vi khuẩn, đặc biệt Staphylococcus aureus kháng thuốc, gây sưng đỏ và tái phát dai dẳng. Nghiên cứu năm 2022 cho thấy 4-isopropyl-3-methylphenol (IPMP) có khả năng phá hủy màng tế bào vi khuẩn, giúp giảm viêm nhanh và an toàn cho da.
Mụn viêm không chỉ là vấn đề thẩm mỹ mà còn là nỗi ám ảnh dai dẳng với nhiều người do tình trạng nhiễm khuẩn lan rộng và tái phát kéo dài. Trong đó, Staphylococcus aureus, đặc biệt là các chủng kháng kháng sinh, đóng vai trò quan trọng trong tiến trình hình thành ổ viêm, gây sưng đỏ, đau nhức và để lại thâm sẹo. Trước thực trạng vi khuẩn ngày càng đề kháng thuốc bôi truyền thống, nhu cầu cấp thiết đặt ra là tìm kiếm hoạt chất mới vừa tiêu diệt vi khuẩn hiệu quả vừa hạn chế kích ứng, an toàn cho làn da.
Một hướng nghiên cứu nổi bật được công bố trên Journal of Microbiology and Biotechnology năm 2022 cho thấy 4-isopropyl-3-methylphenol (IPMP) sở hữu hoạt tính kháng khuẩn mạnh mẽ nhờ khả năng phá hủy màng tế bào vi khuẩn, từ đó giảm nhanh viêm nhiễm trên da mụn.
Bằng chứng khoa học: IPMP tiêu diệt vi khuẩn thông qua cơ chế tấn công màng tế bào
Nghiên cứu của Byung Chan Kim và cộng sự (2022) đã chứng minh IPMP có khả năng kháng khuẩn vượt trội chống lại nhiều chủng vi khuẩn, bao gồm cả Methicillin-Resistant Staphylococcus aureus (MRSA). Cơ chế chính được xác định là:
>> Phá vỡ cấu trúc màng tế bào vi khuẩn, làm rò rỉ thành phần nội bào và dẫn đến chết vi khuẩn nhanh chóng.
>> Hỗ trợ tăng hiệu lực diệt khuẩn khi kết hợp cùng các hoạt chất khác.
>> Giảm nguy cơ kháng thuốc do tác động trực tiếp lên màng tế bào – đích tác dụng khó biến đổi hơn so với enzyme hoặc receptor vi khuẩn.
Đặc biệt, IPMP duy trì hoạt tính cao ở nồng độ thấp và không gây độc tế bào đáng kể, chứng minh tiềm năng ứng dụng an toàn trên da.
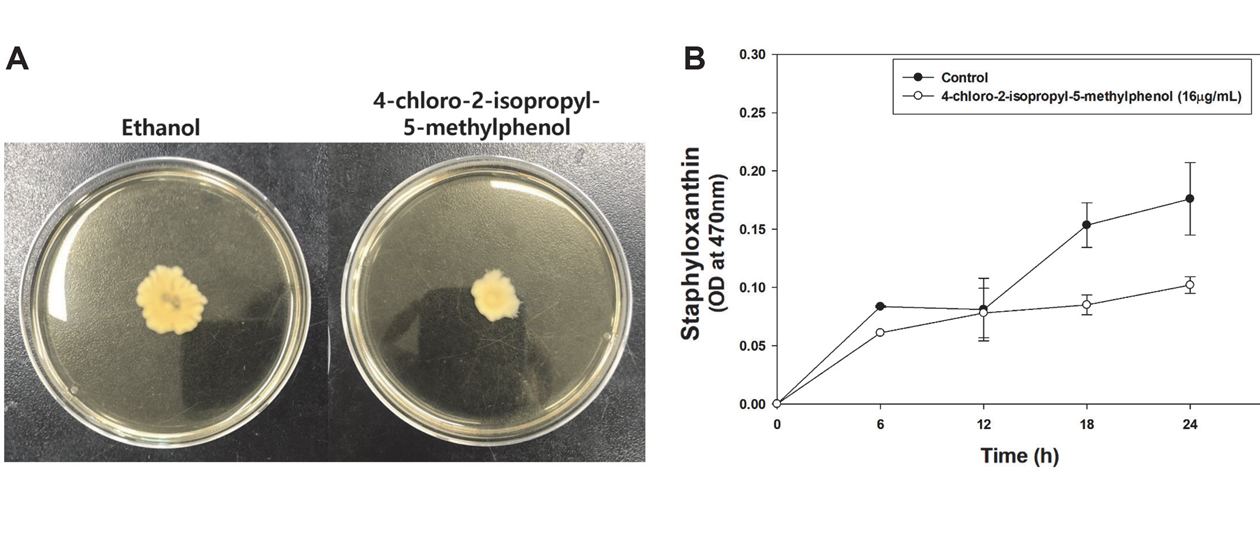
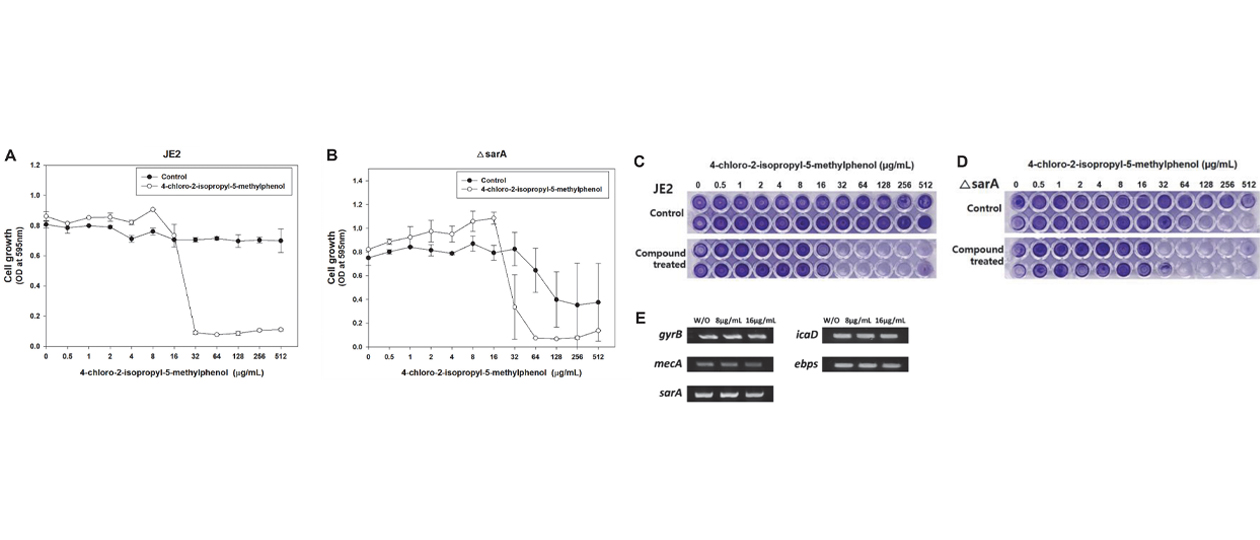
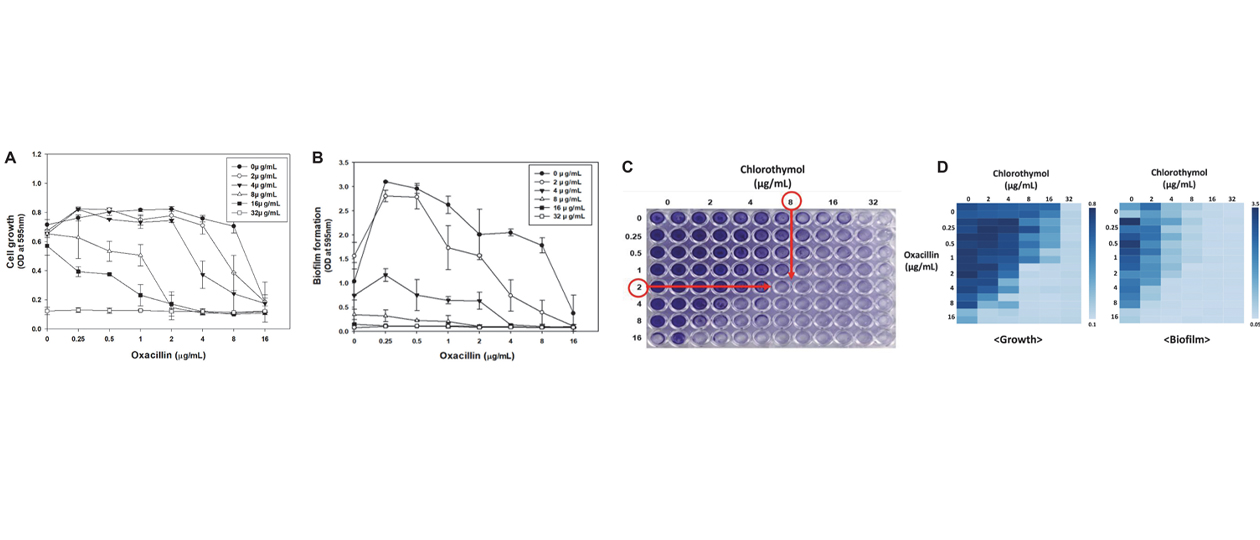
→ Đây là bằng chứng cho thấy chlorothymol có tiềm năng kháng khuẩn và làm suy yếu khả năng gây bệnh của vi khuẩn, đặc biệt là MRSA

>> Cơ chế hoạt động: Diệt khuẩn – Kháng viêm – Ngừa tái phát
IPMP – Bước tiến mới trong kiểm soát mụn viêm an toàn và hiệu quả. IPMP phát huy hiệu quả thông qua 3 cơ chế đồng thời:
>> Phá hủy màng tế bào vi khuẩn, tiêu diệt nhanh vi khuẩn gây mụn (C.acnes, S.aureus).
>> Ức chế phản ứng viêm, giảm sưng đỏ, đau rát quanh nốt mụn.
>> Hạn chế hình thành màng sinh học, giảm nguy cơ tái phát ổ viêm.
Nhờ cơ chế toàn diện, IPMP được đánh giá là một hoạt chất kháng khuẩn thế hệ mới, phù hợp kiểm soát mụn viêm mà không gây khô bong tróc nghiêm trọng.
Gel chấm mụn Rapid Acnes Spot Gel – Công thức chuyên biệt hỗ trợ giảm mụn nhanh chóng

Trên nền tảng khoa học vững chắc, IPMP đã được ứng dụng vào Gel chấm mụn Rapid Acnes Spot Gel, giải pháp chuyên biệt dành cho da mụn viêm với công thức 3 tác động:
>> Isopropyl Methylphenol (IPMP): Hoạt chất chính giúp tiêu diệt vi khuẩn, phá vỡ màng tế bào vi khuẩn, giảm viêm nhanh chóng.
>> Salicylic Acid: Tẩy tế bào chết nhẹ nhàng, làm sạch lỗ chân lông, giảm bít tắc – nguyên nhân hình thành mụn mới.
>> Melaleuca Alternifolia Leaf Oil (Tinh dầu tràm trà): Kháng khuẩn tự nhiên, làm dịu và hỗ trợ tái tạo da sau mụn.
Kết cấu gel thẩm thấu nhanh, tập trung hoạt chất tại ổ mụn, hạn chế lan rộng viêm nhiễm và giúp da phục hồi nhanh hơn.
Hiệu quả tổng hợp: Giảm mụn – Ngừa thâm – Ngăn mụn tái phát
Sử dụng Rapid Acnes Spot Gel đều đặn giúp:
> Làm dịu nhanh sưng đỏ và đau rát
> Giảm rõ rệt kích thước và mức độ viêm của nốt mụn
> Ngăn vi khuẩn lan rộng, hạn chế mụn tái phát
> Thúc đẩy tái tạo tế bào da, giảm thâm sau mụn
Nhờ cơ chế phá hủy màng vi khuẩn và kiểm soát viêm tối ưu, IPMP đã khẳng định giá trị khoa học và tính ứng dụng vượt trội trong điều trị mụn viêm. Rapid Acnes Spot Gel chính là minh chứng cho công nghệ chăm sóc da thế hệ mới – kết hợp giữa hoạt chất kháng khuẩn tiên tiến và các thành phần hỗ trợ tái tạo, làm dịu.
Nếu bạn đang tìm giải pháp giảm mụn nhanh, an toàn, ngăn tái phát, thì sản phẩm Rapid Acnes Spot Gel “must have items”.
___________________
TÀI LIỆU THAM KHẢO
Alanis AJ. 2005. Resistance to antibiotics: Are we in the post-antibiotic era? Arch. Med. Res. 36: 697-705.
Pubmed CrossRef
Imperial ICVJ, Ibana JA. 2016. Addressing the antibiotic resistance problem with probiotics: reducing the risk of its double-edged sword effect. Front. Microbiol. 7: 1983.
Pubmed PMC CrossRef
Miyake Y, Iwai1 T, Sugai M, Miura1 K, Suginaka H, Nagasaka1 N. 1991. Incidence and characterization of Staphylococcus aureus from the tongues of children. J. Dent. Res. 70: 1045-1047.
Pubmed CrossRef
Verhoef J, Beaujean D, Blok H, Baars A, Meyler A, van der Werken C, et al. 1999. A Dutch approach to methicillin-resistant Staphylococcus aureus. Eur. J. Clin. Microbiol. Infect. Dis. 18: 461-466.
Pubmed CrossRef
Peacock SJ, Paterson GK. 2015. Mechanisms of methicillin resistance in Staphylococcus aureus. Ann. Rev. Biochem. 84: 577-601.
Pubmed CrossRef
Blot SI, Vandewoude KH, Hoste EA, Colardyn FA. 2002. Outcome and attributable mortality in critically Ill patients with bacteremia involving methicillin-susceptible and methicillin-resistant Staphylococcus aureus. Arch. Intern. Med 162: 2229-35.
Pubmed CrossRef
Pantosti A, Venditti M. 2009. What is MRSA? Eur. Resp. J. 34: 1190-1196.
Pubmed CrossRef
Boswihi SS, Udo EE. 2018. Methicillin-resistant Staphylococcus aureus? an update on the epidemiology, treatment options and infection control. Curr. Med. Res. Pract. 8: 18-24.
CrossRef
Cuny C, Wieler LH, Witte W. 2015. Livestock-associated MRSA: the impact on humans. Antibiotics 4: 521-543.
Pubmed PMC CrossRef
Diep BA, Otto M. 2008. The role of virulence determinants in community-associated MRSA pathogenesis. Trends Microbiol. 16: 361-369.
Pubmed PMC CrossRef
Yamamoto T, Nishiyama A, Takano T, Yabe S, Higuchi W, Razvina O, et al. 2010. Community-acquired methicillin-resistant Staphylococcus aureus: community transmission, pathogenesis, and drug resistance. J. Infect. Chemother. 16: 225-254.
Pubmed PMC CrossRef
Otto M. 2012. MRSA virulence and spread. Cell. Microbiol. 14: 1513-1521.
Pubmed PMC CrossRef
Wilke MS, Lovering AL, Strynadka NCJ. 2005. β-Lactam antibiotic resistance: a current structural perspective. Curr. Opin. Microbiol. 8: 525-533.
Pubmed CrossRef
Cascioferro S, Carbone D, Parrino B, Pecoraro C, Giovannetti E, Cirrincione G, et al. 2021. Therapeutic strategies to counteract antibiotic resistance in MRSA biofilm-associated infections. ChemMedChem. 16: 65-80.
Pubmed CrossRef
Khatoon Z, McTiernan CD, Suuronen EJ, Mah T-F, Alarcon EI, Alarcon Bacterial EI. 2018. Bacterial biofilm formation on implantable devices and approaches to its treatment and prevention. Heliyon 4: e01067.
Pubmed PMC CrossRef
Holt DC, Holden MTG, Tong SYC, Castillo-Ramirez S, Clarke L, Quail MA, et al. 2011. A very early-branching staphylococcus aureus lineage lacking the carotenoid pigment staphyloxanthin. Genome Biol. Evol. 3: 881-895.
Pubmed PMC CrossRef
Dharmaraja AT. 2017. Role of Reactive Oxygen Species (ROS) in therapeutics and drug resistance in cancer and bacteria. J. Med. Chem. 60: 3221-3240.
Pubmed CrossRef
Xue L, Chen YY, Yan Z, Lu W, Wan D, Zhu H. 2019. Staphyloxanthin: a potential target for antivirulence therapy. Infect. Drug Res. 12: 2151-2160.
Pubmed PMC CrossRef
Pollitt EJG, Crusz SA, Diggle SP. 2015. Staphylococcus aureus forms spreading dendrites that have characteristics of active motility. Sci. Rep. 5: 17698.
Pubmed PMC CrossRef
Cui H, Zhang C, Li C, Lin L. 2020. Inhibition mechanism of cardamom essential oil on methicillin-resistant Staphylococcus aureus biofilm. LWT 122: 109057.
CrossRef
Cheung GYC, Joo HS, Chatterjee SS, Otto M. 2014. Phenol-soluble modulins – critical determinants of staphylococcal virulence. FEMS Microbiol. Rev. 38: 698-719.
Pubmed PMC CrossRef
Chao S, Young G, Oberg C, Nakaoka K. 2008. Inhibition of methicillin-resistant Staphylococcus aureus (MRSA) by essential oils. Flavour Fragr. J. 23: 444-449.
CrossRef
Marchese A, Orhan IE, Daglia M, Barbieri R, di Lorenzo A, Nabavi SF, et al. 2016. Antibacterial and antifungal activities of thymol: a brief review of the literature. Food Chem. 210: 402-414.
Pubmed CrossRef
Kachur K, Suntres Z. 2020. The antibacterial properties of phenolic isomers, carvacrol and thymol. Crit. Rev. Food Sci. Nutr. 60: 3042-3053.
Pubmed CrossRef
Salehi B, Mishra AP, Shukla I, Sharifi-Rad M, Contreras M del M, Segura-Carretero A, et al. 2018. Thymol, thyme, and other plant sources: health and potential uses. Phytother. Res. 32: 1688-1706.
Pubmed CrossRef
Oussalah M, Caillet S, Saucier L, Lacroix M. 2007. Inhibitory effects of selected plant essential oils on the growth of four pathogenic bacteria: E. coli O157:H7, Salmonella Typhimurium, Staphylococcus aureus and Listeria monocytogenes. Food Control 18: 414-420.
CrossRef
Valliammai A, Selvaraj A, Yuvashree U, Aravindraja C, Karutha Pandian S. 2020. sarA-dependent antibiofilm activity of thymol enhances the antibacterial efficacy of rifampicin against Staphylococcus aureus. Front. Microbiol. 11: 1744.
Pubmed PMC CrossRef
Lee HS, Song HS, Lee HJ, Kim SH, Suh MJ, Cho JY, et al. 2021. Comparative study of the difference in behavior of the accessory gene regulator (agr) in USA300 and USA400 community-associated methicillin-resistant Staphylococcus aureus (CA-MRSA). J. Microbiol. Biotechnol. 31: 1060-1068.
Pubmed CrossRef
Choi TR, Song HS, Han YH, Park YL, Park JY, Yang SY, et al. 2020. Enhanced tolerance to inhibitors of Escherichia coli by heterologous expression of cyclopropane-fatty acid-acyl-phospholipid synthase (cfa) from Halomonas socia. Bioprocess Biosys. Eng. 43: 909-918.
Pubmed CrossRef
Peters BM, Ward RM, Rane HS, Lee SA, Noverr MC. 2013. Efficacy of ethanol against Candida albicans and Staphylococcus aureus polymicrobial biofilms. Antimicrob. Agents Chemother. 57: 74-82.
Pubmed PMC CrossRef
Pollitt EJG, Diggle SP. 2017. Defining motility in the Staphylococci. Cell. Mol. Life Sci. 74: 2943-2958.
Pubmed PMC CrossRef
Song HS, Bhatia SK, Choi TR, Gurav R, Kim HJ, Lee SM, et al. 2021. Increased antibiotic resistance of methicillin-resistant Staphylococcus aureus USA300 Δpsm mutants and a complementation study of Δpsm mutants using synthetic phenol-soluble modulins. J. Microbiol. Biotechnol. 31: 115-122.
Pubmed CrossRef
Botelho MG. 2020. Fractional inhibitory concentration index of combinations of antibacterial agents against cariogenic organisms. J. Dent. 28: 565-570.
CrossRef
Meletiadis J, Pournaras S, Roilides E, Walsh TJ. 2010. Defining fractional inhibitory concentration index cutoffs for additive interactions based on self-drug additive combinations, Monte Carlo simulation analysis, and in vitro-in vivo correlation data for antifungal drug combinations against Aspergillus fumigatus. Antimicrob. Agents Chemother. 54: 602-609.
Pubmed PMC CrossRef
Park YL, Bhatia SK, Gurav R, Choi TR, Kim HJ, Song HS, et al. 2020. Fructose based hyper production of poly-3-hydroxybutyrate from Halomonas sp. YLGW01 and impact of carbon sources on bacteria morphologies. Int. J. Biol. Macromol. 154: 929-936.
Pubmed CrossRef
Kim W, Zou G, Hari TPA, Wilt IK, Zhu W, Galle N, et al. 2019. A selective membrane-targeting repurposed antibiotic with activity against persistent methicillin-resistant Staphylococcus aureus. Proc. Natl. Acad. Sci. USA 116: 16529-16534.
Pubmed PMC CrossRef
Kim SM, Zou G, Kim H, Kang M, Ahn S, Heo HY, et al. 2022. Antimicrobial activity of the membrane-active compound nTZDpa is enhanced at low pH. Biomed. Pharmacother. 150: 112977.
Pubmed CrossRef
Muthukrishnan G, Masters EA, Daiss JL, Schwarz EM. 2019. Mechanisms of immune evasion and bone tissue colonization that make Staphylococcus aureus the primary pathogen in osteomyelitis. Curr. Osteoporo. Rep. 17: 395-404.
Pubmed PMC CrossRef
Tsompanidou E, Denham EL, Becher D, de Jong A, Buist G, van Oosten M, et al. 2013. Distinct roles of phenol-soluble modulins in spreading of Staphylococcus aureus on wet surfaces. Appl. Environ. Microbiol. 79: 886-895.
Pubmed PMC CrossRef
Zheng Y, Joo HS, Nair V, Le KY, Otto M. 2018. Do amyloid structures formed by Staphylococcus aureus phenol-soluble modulins have a biological function? Int. J. Med. Microbiol. 308: 675-682.
Pubmed PMC CrossRef
Winterbourn CC, Kettle AJ, Hampton MB. 2016. Reactive oxygen species and neutrophil function. Ann. Rev. Biochem. 85: 765-792.
Pubmed CrossRef
Valliammai A, Selvaraj A, Muthuramalingam P, Priya A, Ramesh M, Pandian SK. 2021. Staphyloxanthin inhibitory potential of thymol impairs antioxidant fitness, enhances neutrophil mediated killing and alters membrane fluidity of methicillin resistant Staphylococcus aureus. Biomed. Pharmacother. 141: 111933.
Pubmed CrossRef
Selvaraj A, Valliammai A, Muthuramalingam P, Priya A, Suba M, Ramesh M, et al. 2020. Carvacrol targets SarA and CrtM of methicillin-resistant Staphylococcus aureus to mitigate biofilm formation and staphyloxanthin synthesis: an in vitro and in vivo approach. ACS Omega 5: 31100-31114.
Pubmed PMC CrossRef
Chan PF, Foster SJ. 1998. Role of SarA in virulence determinant production and environmental signal transduction in Staphylococcus aureus. Am. Soc. Microbiol. 23: 6232-6241.
Pubmed PMC CrossRef
Queck SY, Jameson-Lee M, Villaruz AE, Bach THL, Khan BA, Sturdevant DE, et al. 2008. RNAIII-independent target gene control by the agr quorum-sensing system: insight into the evolution of virulence regulation in Staphylococcus aureus. Mol. Cell 32: 150-158.
Pubmed PMC CrossRef
Shang Wei Wu, de Lencastre H, Tomasz A. 2001. Recruitment of the mecA gene homologue of Staphylococcus sciuri into a resistance determinant and expression of the resistant phenotype in Staphylococcus aureus. J. Bacteriol. 183: 2417-2424.
Pubmed PMC CrossRef
Xue L, Chen YY, Yan Z, Lu W, Wan D, Zhu H. 2019. Staphyloxanthin: a potential target for antivirulence therapy. Infect. Drug Res. 12: 2151-2160.
Pubmed PMC CrossRef
Nemati M, Hermans K, Devriese LA, Maes D, Haesebrouck F. 2009. Screening of genes encoding adhesion factors and biofilm formation in Staphylococcus aureus isolates from poultry. Avian Pathol. 38: 513-517.
Pubmed CrossRef
Phitaktim S, Chomnawang M, Sirichaiwetchakoon K, Dunkhunthod B, Hobbs G, Eumkeb G. 2016. Synergism and the mechanism of action of the combination of α-mangostin isolated from Garcinia mangostana L. and oxacillin against an oxacillin-resistant Staphylococcus saprophyticus. BMC Microbiol. 16: 195.
Pubmed PMC CrossRef
Kowalczyk A, Przychodna M, Sopata S, Bodalska A, Fecka I. 2020. Thymol and thyme essential oil-new insights into selected therapeutic applications. Molecules 25: 4125.
Pubmed PMC