Peel không bong – Xu hướng tất yếu của ngành làm đẹp an toàn Ngành làm đẹp đang bị siết chặt quản lý với...
Mụn viêm từ nhẹ đến vừa không chỉ gây mất thẩm mỹ mà còn ảnh hưởng tâm lý, làm suy giảm chất lượng cuộc sống. Trước đây, các phác đồ điều trị mụn viêm thường sử dụng corticoid hoặc kháng sinh bôi ngoài, nhưng đi kèm nguy cơ cao về kích ứng, khô bong tróc và hiện tượng kháng thuốc. Trong bối cảnh nhu cầu tìm kiếm giải pháp an toàn, tự nhiên và hiệu quả ngày càng tăng, các hoạt chất kháng viêm và kháng khuẩn có nguồn gốc thực vật đã thu hút nhiều sự quan tâm.
Một nghiên cứu tiêu biểu công bố trên Cosmetics (MDPI) năm 2025 đã chứng minh các hợp chất tự nhiên như thymol và tinh dầu từ Curcuma có khả năng giảm viêm vượt trội mà không gây tác dụng phụ nặng nề. Tương tự, Isopropyl Methylphenol (IPMP) cùng tinh dầu tràm trà đã được xác nhận về hiệu quả kiểm soát viêm, diệt khuẩn và cải thiện sức khỏe hàng rào da, mở ra hướng điều trị mụn hiện đại không phụ thuộc corticoid.
Bằng chứng khoa học và cơ chế hoạt động
Nhiều nghiên cứu đã khẳng định hiệu quả vượt trội của Isopropyl Methylphenol (IPMP) trong kiểm soát nhiễm trùng và viêm da mụn. Theo công bố trên Journal of Microbiology and Biotechnology, IPMP thể hiện hoạt tính kháng khuẩn phổ rộng, đặc biệt mạnh mẽ trên Staphylococcus aureus, bao gồm cả các chủng kháng methicillin (MRSA) – một trong những tác nhân chính gây viêm nhiễm lan rộng trong các ổ mụn mủ.
Cơ chế diệt khuẩn của IPMP đã được chứng minh là phá hủy trực tiếp màng tế bào vi khuẩn, gây rò rỉ thành phần nội bào, làm mất cân bằng áp suất thẩm thấu và dẫn đến hoại tử vi khuẩn. Cơ chế này khác biệt so với các kháng sinh cổ điển, giúp giảm thiểu nguy cơ hình thành kháng thuốc. Ngoài ra, dữ liệu thử nghiệm in vitro cho thấy IPMP ức chế đáng kể quá trình sản sinh các chất trung gian gây viêm như PGE₂ (prostaglandin E2) và TNF-α – các cytokine chủ chốt tham gia tiến trình sưng đỏ, đau nhức quanh nốt mụn.
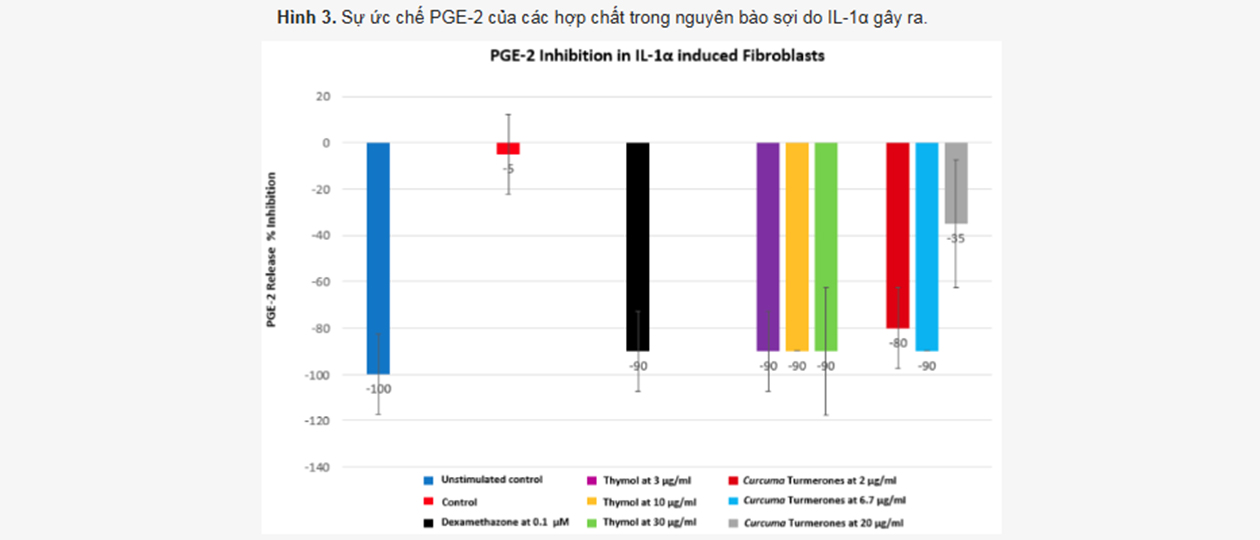
Hình cho thấy khả năng ức chế PGE-2 (một chất gây viêm) của các hoạt chất/kết hợp hoạt chất đang được nghiên cứu. Thí nghiệm được thực hiện trên tế bào sợi (fibroblasts) – là loại tế bào chính tạo ra collagen trong da.
Những tế bào này được kích thích bằng IL-1α – một loại cytokine gây viêm mạnh.
Sau đó, người ta đưa các hoạt chất vào để xem chúng có giảm sản sinh PGE-2 không.
Nếu hoạt chất có khả năng ức chế PGE-2 tốt, thì chúng có tiềm năng làm dịu viêm, chống lão hóa hoặc phục hồi da sau tổn thương (vì viêm kéo dài có thể phá hủy collagen và làm da nhanh lão hóa).
Song song với IPMP, nhiều hoạt chất kháng viêm tự nhiên đang được quan tâm như thymol, tinh dầu nghệ (Curcuma longa), hay tinh dầu tràm trà (Melaleuca alternifolia). Nghiên cứu của Steve Thomas Pannakal và cộng sự công bố năm 2025 trên tạp chí Cosmetics (MDPI) đã chứng minh rằng các chiết xuất thảo dược này có thể:
Giảm mức độ viêm ở mô da tới hơn 60% so với chứng không điều trị.
Đạt hiệu quả ức chế phản ứng viêm tương đương corticoid nhẹ (hydrocortisone 1%) nhưng ít gây kích ứng, bong tróc hay teo da khi dùng kéo dài.
Hạn chế sự phát triển của Cutibacterium acnes – vi khuẩn góp phần hình thành nhân mụn.
Đặc biệt, tinh dầu tràm trà chứa tỷ lệ cao terpinen-4-ol, thành phần được chứng minh có hoạt tính kháng khuẩn và kháng viêm kép, hỗ trợ giảm nhanh sưng tấy quanh ổ mụn, thúc đẩy liền thương và ngăn hình thành thâm sẹo sau viêm.
Salicylic Acid – thành phần quen thuộc trong trị liệu mụn – đóng vai trò thiết yếu trong cơ chế “bóc tách vi sinh vật và mảng bám”, nhờ khả năng tan trong dầu, xuyên qua lớp bã nhờn, làm sạch sâu lỗ chân lông, ngăn vi khuẩn và tế bào sừng tích tụ.
Khi phối hợp IPMP, Salicylic Acid và tinh dầu tràm trà, sản phẩm đạt hiệu ứng cộng hưởng hiếm có: vừa tiêu diệt vi khuẩn, vừa điều hòa phản ứng viêm, đồng thời hỗ trợ phục hồi làn da tổn thương.
Một tuýp gel – ba cơ chế – giải pháp trị mụn viêm nhẹ đến vừa an toàn
Rapid Acnes Spot Gel là thành quả của quá trình nghiên cứu, phát triển công thức dựa trên các bằng chứng khoa học về hiệu quả kháng khuẩn và kháng viêm an toàn, phù hợp với xu hướng trị mụn không kháng sinh, không corticoid.

Sản phẩm ứng dụng công thức độc quyền kết hợp ba cơ chế tác động bổ trợ lẫn nhau nhằm kiểm soát toàn diện nguyên nhân sinh mụn:
>> Isopropyl Methylphenol (IPMP):
Hoạt chất được cấp bằng sáng chế quốc tế về khả năng tiêu diệt vi khuẩn gây mụn. IPMP tác động trực tiếp bằng cách phá vỡ màng tế bào vi khuẩn (Staphylococcus aureus và C. acnes), làm mất khả năng sinh tồn và nhân lên. Đồng thời, IPMP còn ức chế giải phóng các chất trung gian gây viêm (như PGE₂), góp phần giảm nhanh tình trạng sưng đỏ, đau nhức ở mụn viêm.
>> Salicylic Acid:
Acid beta-hydroxy tan trong dầu, có khả năng xuyên sâu qua lớp bã nhờn và tế bào sừng, làm sạch triệt để nhân mụn và bít tắc trong nang lông. Cơ chế này không chỉ loại bỏ môi trường thuận lợi cho vi khuẩn phát triển mà còn giúp hạn chế hình thành mụn mới. Nghiên cứu lâm sàng đã chỉ ra salicylic acid nồng độ phù hợp có thể giảm rõ rệt số lượng tổn thương mụn viêm sau 4–6 tuần sử dụng đều đặn.
>> Tinh dầu tràm trà (Melaleuca alternifolia Leaf Oil):
Dầu tràm trà chứa hàm lượng cao terpinen-4-ol, hoạt chất đã được chứng minh có đặc tính kháng khuẩn, kháng nấm và kháng viêm tự nhiên. Cơ chế điều hòa đáp ứng miễn dịch tại chỗ giúp giảm nhanh đỏ rát, thúc đẩy phục hồi hàng rào bảo vệ da và hạn chế hình thành thâm sau viêm. Đây là lựa chọn lý tưởng thay thế corticoid trong kiểm soát viêm nhẹ–vừa mà không gây mỏng da hay teo da khi sử dụng dài ngày.
Nhờ sự phối hợp chặt chẽ của 3 thành phần hoạt tính, Rapid Acnes Spot Gel tạo ra hiệu ứng cộng hưởng vượt trội:
>> Diệt khuẩn – Giảm viêm – Làm thông thoáng lỗ chân lông
>> Ngăn chặn tiến trình hình thành mụn mới và rút ngắn thời gian hồi phục tổn thương
>> Giảm đáng kể nguy cơ thâm, sẹo sau mụn
Sản phẩm được chỉ định đặc biệt trong các trường hợp:
>> Mụn viêm nhẹ đến vừa (mụn mủ, mụn sẩn, mụn bọc nhỏ)
>> Da dầu dễ tái phát mụn do bít tắc lỗ chân lông
>> Người cần liệu pháp điều trị không kháng sinh, không corticoid dài hạn
>> Da nhạy cảm, dễ kích ứng với benzoyl peroxide hoặc retinoid
Sử dụng đều đặn, Rapid Acnes Spot Gel có thể hỗ trợ:
>> Rút ngắn thời gian gom cồi và khô nhân mụn
>> Giảm nhanh cảm giác đau nhức, sưng tấy
>> Hạn chế nguy cơ bùng phát ổ viêm mới
Trong bối cảnh vi khuẩn ngày càng kháng thuốc và người dùng thận trọng hơn với corticoid, các giải pháp kháng viêm tự nhiên như IPMP và tinh dầu tràm trà chính là bước tiến mới trong kiểm soát mụn viêm an toàn, bền vững. Rapid Acnes Spot Gel không chỉ giảm mụn hiệu quả mà còn chăm sóc da toàn diện, duy trì trạng thái khỏe mạnh lâu dài.
Nếu bạn đang tìm kiếm sản phẩm chấm mụn vừa mạnh mẽ vừa dịu nhẹ, đây chính là lựa chọn đáng cân nhắc để đưa vào quy trình chăm sóc da của mình ngay hôm nay.
___________________
TÀI LIỆU THAM KHẢO
Tuchayi, M.S.; Makrantonaki, E.; Ganceviciene, R.; Dessinioti, C.; Feldman, S.R.; Zouboulis, C.C. Acne vulgaris. Nat. Rev. Dis. Primers 2015, 1, 15029. [Google Scholar] [CrossRef] [PubMed]
Yentzer, B.A.; Hick, J.; Reese, E.L.; Uhas, A.; Feldman, S.R.; Balkrishnan, R. Acne vulgaris in the United States: Descriptive epidemiology. Cutis 2010, 86, 94. [Google Scholar] [PubMed]
McConnell, R.C.; Fleischer, A.B.; Williford, P.M.; Feldman, S.R. Most topical tretinoin treatment is for acne vulgaris through the age of 44 years: An analysis of the National Ambulatory Medical Care Survey. J. Am. Acad. Dermatol. 1998, 38, 221. [Google Scholar] [CrossRef] [PubMed]
Bernales, S.A. Acne vulgaris: Role of the immune system. Int. J. Dermatol. 2021, 60, 1076. [Google Scholar] [CrossRef]
Cong, T.X.; Hao, D.; Wen, X.; Li, X.; He, G.; Jiang, X. From pathogenesis of acne vulgaris to anti-acne agents. Arch. Dermatol. Res. 2019, 311, 337. [Google Scholar] [CrossRef] [PubMed]
Barnard, E.; Shi, B.; Kang, D.; Craft, N.; Li, H. The balance of metagenomic elements shapes the skin microbiome in acne and health. Sci. Rep. 2016, 6, 39491. [Google Scholar] [CrossRef] [PubMed]
Suh, D.H.; Kwon, H.H. What’s new in the physiopathology of acne? Br. J. Dermatol. 2015, 172, 13. [Google Scholar] [CrossRef] [PubMed]
Lee, Y.B.; Byun, E.J.; Kim, H.S. Potential role of the microbiome in acne: A comprehensive review. J. Clin. Med. 2019, 8, 987. [Google Scholar] [CrossRef] [PubMed]
Dréno, B.; Dagnelie, M.A.; Khammari, A.; Corvec, S. The Skin Microbiome: A New Actor in Inflammatory Acne. Am. J. Clin. Dermatol. 2020, 21, 18. [Google Scholar] [CrossRef] [PubMed]
Zaenglein, A.L.; Pathy, A.L.; Schlosser, B.J.; Alikhan, A.; Baldwin, H.E.; Berson, D.S.; Bhushan, R. Guidelines of care for the management of acne vulgaris. J. Am. Acad. Dermatol. 2016, 74, 945. [Google Scholar] [CrossRef]
Amed, I.; Berg, A.; Hudson, S.; Weaver, K.K.; Pacchia, M.L. The Beauty Market in 2023: A Special State of Fashion Report. Available online: https://www.mckinsey.com/industries/retail/our-insights/the-beauty-market-in-2023-a-special-state-of-fashion-report (accessed on 22 December 2024).
Borris, R.P. Natural products research: Perspectives from a major pharmaceutical company. J. Ethnopharmacol. 1996, 51, 29. [Google Scholar] [CrossRef] [PubMed]
Wright, C.W. Plant derived antimalarial agents: New leads and challenges. Phytochem. Rev. 2005, 4, 55. [Google Scholar] [CrossRef]
Marquez-Valadez, B.; Maldonado, P.D.; Galvan-Arzate, S.; Méndez-Cuesta, L.A.; Pérez-De La Cruz, V.; Pedraza-Chaverrí, J.; Chánez-Cárdenas, M.E.; Santamaría, A. Alpha-mangostin induces changes in glutathione levels associated with glutathione peroxidase activity in rat brain synaptosomes. Nutr. Neurosci. 2012, 15, 13. [Google Scholar] [CrossRef] [PubMed]
Qi, S.; Xin, Y.; Guo, Y.; Diao, Y.; Kou, X.; Luo, L.; Yin, Z. Ampelopsin reduces endotoxic infammation via repressing ROS-mediated activation of PI3K/Akt/NF-κB signaling pathways. Int. Immunopharmacol. 2012, 12, 278. [Google Scholar] [CrossRef]
Etti, I.C.; Abdullah, R.; Kadir, A.; Hashim, N.M.; Yeap, S.K.; Imam, M.U.; Ramli, F.; Malami, I.; Lam, K.L.; Etti, U.; et al. The molecular mechanism of the anticancer effect of Artonin E in MDA-MB 231 triple negative breast cancer cells. PLoS ONE 2017, 12, e0182357. [Google Scholar] [CrossRef]
Li, C.G.; Yan, L.; Jing, Y.Y.; Xu, L.H.; Liang, Y.D.; Wei, H.X.; Hu, B.; Pan, H.; Zha, Q.B.; Ouyang, D.Y.; et al. Berberine augments ATP induced infammasome activation in macrophages by enhancing AMPK signaling. Oncotarget 2017, 8, 95. [Google Scholar] [CrossRef]
Farzaei, M.H.; Zobeiri, M.; Parvizi, F.; El-Senduny, F.F.; Marmouzi, I.; Coy-Barrera, E.; Naseri, R.; Nabavi, S.M.; Rahimi, R.; Abdollahi, M. Curcumin in liver diseases: A systematic review of the cellular mechanisms of oxidative stress and clinical perspective. Nutrients 2018, 10, 7. [Google Scholar] [CrossRef] [PubMed]
Umesalma, S.; Sudhandiran, G. Differential inhibitory effects of the polyphenol ellagic acid on infammatory mediators NF-κB, iNOS, COX-2, TNF-α, and IL-6 in 1, 2-dimethylhydrazine-induced rat colon carcinogenesis. Basic Clin. Pharmacol. Toxicol. 2010, 107, 650. [Google Scholar] [CrossRef] [PubMed]
Yang, N.; Zhang, H.; Cai, X.; Shang, Y. Epigallocatechin3-gallate inhibits infammation and epithelialmesenchymal transition through the PI3K/AKT pathway via upregulation of PTEN in asthma. Int. J. Mol. Med. 2018, 41, 818. [Google Scholar]
Soleymani, S.; Farzaei, M.H.; Zargaran, A.; Niknam, S.; Rahimi, R. Promising plant-derived secondary metabolites for treatment of acne vulgaris: A mechanistic review. Arch. Dermatol. Res. 2020, 312, 5. [Google Scholar] [CrossRef]
Amiri, H. Essential oils composition and antioxidant properties of three Thymus species. Evid. Based Complement. Alternat. Med. 2012, 2012, 728065. [Google Scholar] [CrossRef] [PubMed]
Bairwa, R.; Sodha, R.S.; Rajawat, B.S. Trachyspermum ammi. Pharmacogn. Rev. 2012, 6, 56. [Google Scholar] [CrossRef] [PubMed]
Yousefzadi, M.; Riahi-Madvar, A.; Hadian, J.; Rezaee, F.; Rafiee, R. In vitro cytotoxic and antimicrobial activity of essential oil from Satureja sahendica. Toxicol. Environ. Chem. 2012, 94, 1735. [Google Scholar] [CrossRef]
Markovic, P.; Chatzopoulou, P.; Siljegovic, J.; Nikolic, M.; Glamoclija, J.; Ciric, A.; Soković, M. Chemical analysis and antimicrobial activities of the essential oils of Satureja thymbra L. and Thymbra spicata L. and their main components. Arch. Biol. Sci. 2011, 63, 457. [Google Scholar] [CrossRef]
Khajeh, M.; Yamini, Y.; Sefidkon, F.; Bahramifar, N. Comparison of essential oil composition of Carum copticum obtained by supercritical carbon dioxide extraction and hydrodistillation methods. Food Chem. 2004, 86, 587. [Google Scholar] [CrossRef]
Ghosheh, O.A.; Houdi, A.A.; Crooks, P.A. High performance liquid chromatographic analysis of the pharmacologically active quinones and related compounds in the oil of the black seed (Nigella sativa L.). J. Pharm. Biomed. Anal. 1999, 19, 757. [Google Scholar] [CrossRef] [PubMed]
Didri, N.; Dubreuil, L.; Pinkas, M. Activity of thymol, carvacrol, cinnamaldehyde and eugenol on oral bacteria. Pharm. Acta Helv. 1994, 69, 25. [Google Scholar] [CrossRef]
Aeschbach, R.; Loliger, J.; Scott, B.C.; Murcia, A.; Butler, J.; Halliwell, M.; Aruoma, O.I. Antioxidant actions of thymol, carvacrol, 6-gingerol, zingerone and hydroxytyrosol. Food Chem. Toxicol. 1994, 32, 31. [Google Scholar] [CrossRef] [PubMed]
Mahmoud, A.L. Antifungal action and antiaflatoxigenic properties of some essential oil constituents. Lett. Appl. Microbiol. 1994, 19, 110. [Google Scholar] [CrossRef] [PubMed]
Yanishlieva, N.V.; Marinovaa, E.M.; Gordon, M.H.; Raneva, V.G. Antioxidant activity and mechanism of action of thymol and carvacrol in two lipid systems. Food Chem. 1999, 64, 59. [Google Scholar] [CrossRef]
Frank, J.; McEnroe, W.F. Structures and synthesis of some new antibacterial sesquiterpenoids from the gorgonian coral Pseudopterogorgia rigida. Tetrahedron 1978, 34, 1661. [Google Scholar]
Itokawa, H.; Shi, Q.; Akiyama, T.; Morris-Natschke, S.L.; Lee, K.H. Recent advances in the investigation of curcuminoids. Chin. Med. 2008, 17, 11. [Google Scholar] [CrossRef]
Hwang, J.K.; Sim, J.S.; Baek, N.I.; Pyun, Y.R. Xanthorrhizol: A potential antibacterial agent from Curcuma xanthorrhiza against Streptococcus mutans. Planta Med. 2000, 66, 196. [Google Scholar] [CrossRef]
Chun, K.S.; Sohn, Y.; Kim, H.S.; Kim, O.H.; Park, K.K.; Lee, J.M.; Lee, J.; Lee, J.Y.; Moon, A.; Lee, S.S.; et al. Anti-tumor promoting potential of naturally occurring diarylheptanoids structurally related to curcumin. Mutat. Res. 1999, 428, 49. [Google Scholar] [CrossRef] [PubMed]
Imtiyaz, A.S.; Venkatesalu, V. Botany, traditional uses, phytochemistry and pharmacological properties of Saussurea costus—An endangered plant from Himalaya—A review. Phytochem. Lett. 2022, 47, 140. [Google Scholar]
Bokshan, S.L.; Gomez, J.R.; Chapin, K.C.; Green, A.; Paxton, E.S. Reduced Time to Positive Cutibacterium acnes Culture Utilizing a Novel Incubation Technique: A Retrospective Cohort Study. J. Shoulder Elb. Arthroplast. 2019, 3, 2471549219840823. [Google Scholar] [CrossRef] [PubMed]
Nazzaro, F.; Fratianni, F.; De Martino, L.; Coppola, R.; De Feo, V. Effect of Essential Oils on Pathogenic Bacteria. Pharmaceuticals 2013, 6, 1451. [Google Scholar] [CrossRef] [PubMed]
Trombetta, D.; Castelli, F.; Sarpietro, M.G.; Venuti, V.; Cristani, M.; Daniele, C.; Saija, A.; Mazzanti, G.; Bisignano, G. Mechanisms of antibacterial action of three monoterpenes. Antimicrob. Agents Chemother. 2005, 49, 2474. [Google Scholar] [CrossRef] [PubMed]
Khameneh, B.; Eskin, N.A.M.; Iranshahy, M.; Fazly, B.B.S. Phytochemicals: A Promising Weapon in the Arsenal against Antibiotic-Resistant Bacteria. Antibiotics 2021, 10, 1044. [Google Scholar] [CrossRef] [PubMed]
Sikkema, J.; De Bont, J.A.M.; Poolman, B. Mechanisms of membrane toxicity of hydrocarbons. Microbiol. Rev. 1995, 59, 201. [Google Scholar] [CrossRef] [PubMed]
Yousfi, F.; Abrigach, F.; Petrovic, J.D.; Sokovic, M.; Ramdani, M. Phytochemical screening and evaluation of the antioxidant and antibacterial potential of Zingiber officinale extracts. S. Afr. J. Bot. 2021, 142, 433. [Google Scholar] [CrossRef]
Xu, J.; Zhou, F.; Ji, B.P.; Pei, R.S.; Xu, N. The antibacterial mechanism of carvacrol and thymol against Escherichia coli. Lett. Appl. Microbiol. 2008, 47, 174. [Google Scholar] [CrossRef] [PubMed]
Poudel, D.K.; Ojha, P.K.; Rokaya, A.; Satyal, R.; Satyal, P.; Setzer, W.N. Analysis of Volatile Constituents in Curcuma Species, viz. C. aeruginosa, C. zedoaria, and C. longa, from Nepal. Plants 2022, 26, 1932. [Google Scholar]
Yasni, S.; Imaizumi, K.; Sin, K.; Sugano, M.; Nonaka, G.; Sidik, P. Identification of an active principle in essential oils and hexane-soluble fractions of Curcuma xanthorrhiza Roxb. showing triglyceride-lowering action in rats. Food Chem. Toxicol. 1994, 32, 273. [Google Scholar] [CrossRef] [PubMed]
Uehara, S.; Yasuda, I.; Takeya, K.; Itokawa, H. Terpenoids and curcuminoids of the rhizoma of Curcuma xanthorrhiza roxb. J. Pharm. Soc. Jpn. 1992, 112, 817. [Google Scholar] [CrossRef] [PubMed]
Hong, C.H.; Kim, Y.; Lee, S.K. Sesquiterpenoids from the rhizome of Curcuma zedoaria. Arch. Pharm. Res. 2001, 24, 424. [Google Scholar] [CrossRef]
Martins, A.P.; Salgueiro, L.; Goncalves, M.J.; da Cunha, A.P.; Vila, R.; Canigueral, S.; Mazzoni, V.; Tomi, F.; Casanova, J. Essential oil composition and antimicrobial activity of three Zingiberaceae from S.Tome E principe. Planta Med. 2001, 67, 580. [Google Scholar] [CrossRef] [PubMed]
Ciosek, J. Understanding of transmittance. Proc. SPIE-Int. Soc. Opt. Eng. 2003, 5064, 287–294. [Google Scholar]
Hwang, J.K.; Shim, J.S.; Pyun, Y.R. Antibacterial activity of xanthorrhizol from Curcuma xanthorrhiza against oral pathogens. Fitoterapia 2000, 71, 321. [Google Scholar] [CrossRef]
Stein Gold, L.F. What’s new in acne and inflammation. J. Drugs Dermatol. 2013, 12, s67. [Google Scholar]
Weiss, J.S. Messages from molecules: Deciphering the code. J. Drugs Dermatol. 2013, 12, s70. [Google Scholar]
Bellew, S.; Thiboutot, D.; Del Rosso, J.Q. Pathogenesis of acne vulgaris: What’s new, what’s interesting and what may be clinically relevant. J. Drugs Dermatol. 2011, 10, 582. [Google Scholar]
Del Bufalo, A.; Bernad, J.; Dardenne, C.; Verda, D.; Meunier, J.R.; Rousset, F.; Martinozzi-Teissier, S.; Pipy, B. Contact sensitizers modulate the arachidonic acid metabolism of PMA-differentiated U-937 monocytic cells activated by LPS. Toxicol. Appl. Pharmacol. 2011, 256, 35. [Google Scholar] [CrossRef] [PubMed]
Zhao, Y.-L.; Lu, Z.-Y.; Zhang, X.; Liu, W.-W.; Yao, G.-D.; Liu, X.-L.; Liu, W.; Wu, Q.-J.; Hayashi, T.; Yamato, M.; et al. Gelatin promotes cell aggregation and pro-inflammatory cytokine production in PMA-stimulated U937 cells by augmenting endocytosis-autophagy pathway. Int. J. Biochem. Cell Biol. 2018, 95, 132. [Google Scholar] [CrossRef]
Vassiliou, E.; Awoleye, O.; Davis, A.; Mishra, S. Anti-Inflammatory and Antimicrobial Properties of Thyme Oil and Its Main Constituents. Int. J. Mol. Sci. 2023, 24, 6936. [Google Scholar] [CrossRef]
Wang, Q.; Cheng, F.; Xu, Y.; Zhang, J.; Qi, J.; Liu, X.; Wang, R. Thymol alleviates lipopolysaccharide-stimulated inflammatory response via downregulation of RhoA-mediated NF-κB signalling pathway in human peritoneal mesothelial cells. Eur. J. Pharmacol. 2018, 833, 210. [Google Scholar] [CrossRef]
Kwon, H.I.; Jeong, N.H.; Kim, S.Y.; Kim, M.H.; Son, J.H.; Jun, S.H.; Kim, S.; Jeon, H.; Kang, S.C.; Kim, S.H.; et al. Inhibitory effects of thymol on the cytotoxicity and inflammatory responses induced by Staphylococcus aureus extracellular vesicles in cultured keratinocytes. Microb. Pathog. 2019, 134, 103603. [Google Scholar] [CrossRef] [PubMed]
Sköld, K.; Twetman, S.; Hallgren, A.; Yucel-Lindberg, T.; Modéer, T. Effect of a chlorhexidine/thymol-containing varnish on prostaglandin E2 levels in gingival crevicular fluid. Eur. J. Oral Sci. 1998, 106, 571. [Google Scholar] [CrossRef] [PubMed]
Marsik, P.; Kokoska, L.; Landa, P.; Nepovim, A.; Soudek, P.; and Vanek, T. In vitro inhibitory effects of thymol and quinones of Nigella sativa seeds on cyclooxygenase-1- and -2-catalyzed prostaglandin E2 biosyntheses. Planta Med. 2005, 71, 739. [Google Scholar] [CrossRef]
Cordier-Dirikoc, S.; Pedretti, N.; Garnier, J.; Clarhaut-Charreau, S.; Ryffel, B.; Morel, F.; Bernard, F.X.; Hamon de Almeida, V.; Lecron, J.C.; Jégou, J.F. Dermal fibroblasts are the key sensors of aseptic skin inflammation through interleukin 1 release by lesioned keratinocytes. Front. Immunol. 2022, 13, 984045. [Google Scholar] [CrossRef] [PubMed]
Kupper, T.S.; Ballard, D.W.; Chua, A.O.; McGuire, J.S.; Flood, P.M.; Horowitz, M.C.; Langdon, R.; Lightfoot, L.; Gubler, U. Human keratinocytes contain mRNA indistinguishable from monocyte interleukin 1 alpha and beta mRNA. Keratinocyte epidermal cell-derived thymocyte-activating factor is identical to interleukin 1. J. Exp. Med. 1986, 164, 2095. [Google Scholar] [CrossRef] [PubMed]
Mohan, S.; Ahmad, A.S.; Glushakov, A.V.; Chambers, C.; Doré, S. Putative role of prostaglandin receptor in intracerebral hemorrhage. Front. Neurol. 2012, 3, 145. [Google Scholar] [CrossRef] [PubMed]
Cho, J.S.; Han, I.H.; Lee, H.R.; Lee, H.M. Prostaglandin E2 Induces IL-6 and IL-8 Production by the EP Receptors/Akt/NF-κB Pathways in Nasal Polyp-Derived Fibroblasts. Allergy Asthma Immunol. Res. 2014, 6, 449. [Google Scholar] [CrossRef] [PubMed]
Wang, P.; Zhu, F.; Konstantopoulos, K. Prostaglandin E2 induces interleukin-6 expression in human chondrocytes via cAMP/protein kinase A- and phosphatidylinositol 3-kinase-dependent NF-kappaB activation. Am. J. Physiol. Cell Physiol. 2010, 298, C1445. [Google Scholar] [CrossRef] [PubMed]
Lee, S.K.; Hong, C.H.; Huh, S.K.; Kim, S.S.; Oh, O.J.; Min, H.Y.; Park, K.K.; Choong, W.Y.; Hwang, J.K. Suppressive effect of natural sesquiterpenoids on inducible cyclooxygenase (COX-2) and nitric oxide synthase (iNOS) activity in mouse macrophage cells. J. Environ. Pathol. Toxicol. Oncol. 2002, 21, 141. [Google Scholar] [CrossRef]


