Peel không bong – Xu hướng tất yếu của ngành làm đẹp an toàn Ngành làm đẹp đang bị siết chặt quản lý với...
Khô căng, mất nước, kém đàn hồi – đây không chỉ là biểu hiện thường gặp ở làn da lão hóa mà còn phổ biến ở những làn da yếu, tổn thương do điều trị thẩm mỹ hoặc ảnh hưởng từ môi trường. Trong khi các sản phẩm bôi ngoài da chỉ tác động bề mặt, thì giải pháp nuôi dưỡng làn da từ tầng sâu – kích thích phục hồi nội sinh đang trở thành xu hướng mới. Một trong những giải pháp được chứng minh hiệu quả nổi bật là kết hợp Hyaluronic Acid (HA), amino acid và vitamin chống oxy hóa trong liệu pháp chăm sóc da chuyên sâu
Bằng chứng khoa học về hiệu quả của công thức dưỡng da nội sinh
Một nghiên cứu lâm sàng được công bố năm 2024 trên tạp chí khoa học Antioxidants (MDPI) đã cung cấp dữ liệu rất giá trị về tác động thực sự của công thức kết hợp Hyaluronic Acid, amino acid và vitamin chống oxy hóa trên nền da khỏe mạnh.
Thiết kế nghiên cứu:
Đối tượng: 40 tình nguyện viên khỏe mạnh, không mắc bệnh da liễu cấp tính.
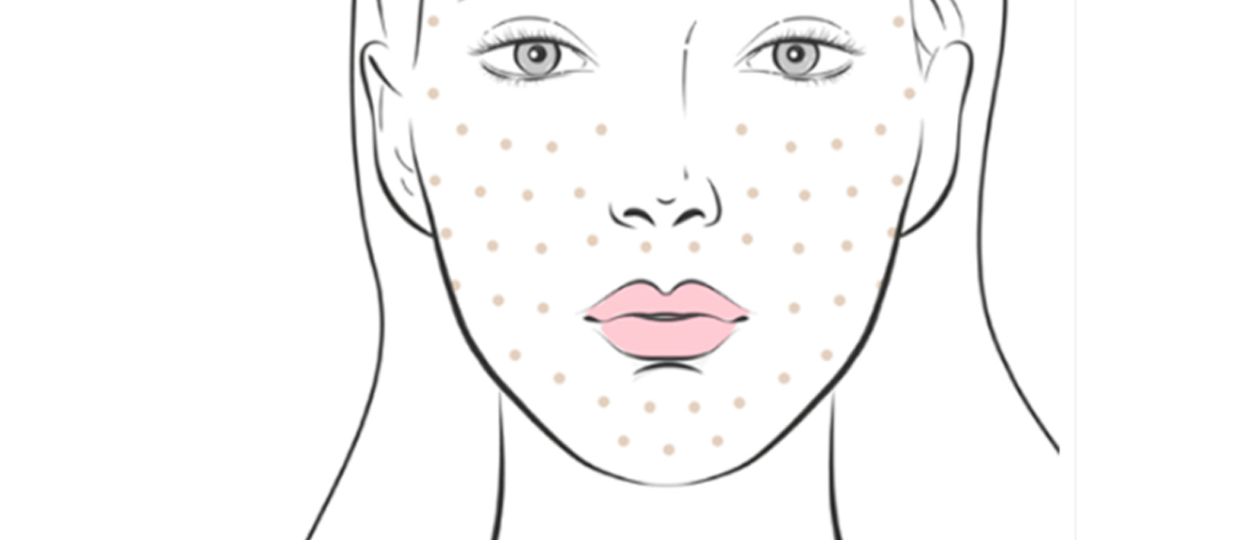
Can thiệp: Tiêm 3 lần liên tiếp trong thời gian ngắn hỗn hợp hoạt chất vào vùng da mặt.
Thời gian theo dõi: 42 ngày sau lần tiêm cuối cùng.
Chỉ tiêu đánh giá:
>> Độ ẩm biểu bì
>> Độ dày lớp da
>> Mức độ vi tuần hoàn da
>> Các chỉ số lâm sàng về độ đàn hồi, độ sáng và kết cấu da
Kết quả nổi bật:
>> Độ ẩm da tăng trung bình 11–12%: Điều này cho thấy khả năng tái thiết lập trạng thái ngậm nước nội sinh của biểu bì, cải thiện tình trạng khô căng vốn dễ gặp ở da lão hóa hoặc da yếu sau điều trị.
>> Độ dày da tăng 23%: Sự gia tăng này được đánh giá bằng siêu âm da (high-frequency ultrasound), phản ánh tăng mật độ mô liên kết và chất nền ngoại bào (ECM), một chỉ số quan trọng để làm dày và củng cố cấu trúc nền da.
>> Vi tuần hoàn da cải thiện 27%: Lưu lượng máu dưới da gia tăng giúp cung cấp oxy, dinh dưỡng, đồng thời tăng khả năng tự phục hồi của mô da.
Cải thiện lâm sàng rõ rệt:
>> Da sáng màu hơn, sắc tố đồng đều.
>> Độ đàn hồi da tăng đáng kể, kiểm tra bằng thiết bị đo độ đàn hồi (cutometer).
>> Bề mặt da mịn màng, săn chắc, ít nhăn nhỏ li ti.
Phân tích hiệu quả hiệp đồng:
Nghiên cứu nhấn mạnh rằng không phải một thành phần đơn lẻ mà sự kết hợp ba nhóm hoạt chất đã mang lại kết quả vượt trội.
>> Hyaluronic Acid (HA): Bám dính trên mô liên kết, gắn nước gấp 1000 lần khối lượng, giúp căng đầy mô da.
>> Amino Acid Complex: Hoạt động như tiền chất (precursor) để kích thích sinh tổng hợp collagen và elastin, từ đó củng cố độ dày và độ săn chắc của lớp hạ bì.
>> Vitamin chống oxy hóa: (A, C, E) trung hòa gốc tự do, giảm stress oxy hóa – yếu tố thúc đẩy lão hóa sớm và phá hủy mạng lưới collagen.
Các nhà nghiên cứu kết luận rằng công thức này không chỉ tác động bề mặt, mà còn thúc đẩy các quá trình tái tạo mô sâu – điều các sản phẩm bôi ngoài khó đạt được.

Ứng dụng thực tiễn: Công nghệ phục hồi chuyên sâu trong sản phẩm Ha-Pcell
Dựa trên nền tảng dữ liệu lâm sàng được kiểm chứng và các công bố khoa học quốc tế, Ha-Pcell được phát triển như một giải pháp phục hồi, tái thiết và bảo vệ nền da đa tầng, đáp ứng nhu cầu ngày càng cao về chăm sóc da sau trị liệu và da lão hóa sớm.
Đối tượng sử dụng lý tưởng:
Ha-Pcell phù hợp với nhiều tình trạng da đang suy yếu hoặc mất cân bằng chức năng hàng rào bảo vệ:
>> Da khô, bong tróc, thiếu sức sống:
>> Mất nước mạn tính khiến hàng rào lipid suy yếu, da kém căng bóng, sạm màu, dễ kích ứng.
>> Da yếu, tổn thương sau peel hóa học, laser, IPL, RF: Sau các thủ thuật xâm lấn hoặc bán xâm lấn, quá trình tái tạo mô cần một lượng lớn acid amin, chất chống oxy hóa và độ ẩm nội sinh để phục hồi nhanh, hạn chế nguy cơ tăng sắc tố hậu viêm (PIH).
>> Da lão hóa hoặc có dấu hiệu mất đàn hồi: Suy giảm tổng hợp collagen và elastin làm da nhăn nhỏ, kém săn chắc, mất độ đàn hồi vốn có.
Thành phần nổi bật và vai trò khoa học:
Hyaluronic Acid phân tử nhỏ và vừa:
>> Được tối ưu hóa để thẩm thấu tốt qua biểu bì, tạo lớp đệm ẩm sâu, kích hoạt tế bào nguyên bào sợi tăng sản xuất glycosaminoglycan tự nhiên.
>> Giúp khôi phục độ dày lớp mô liên kết, làm đầy nếp nhăn li ti và giảm hiện tượng da lộ mao mạch.
Amino Acid Complex đa thành phần:
>> Cung cấp hỗn hợp acid amin thiết yếu (glycine, proline, lysine, alanine…) – tiền chất cấu trúc cần thiết để tái tổng hợp collagen type I, III và protein nền (laminin, fibronectin).
>> Hỗ trợ quá trình sửa chữa vi tổn thương vi mô trên da yếu sau can thiệp thẩm mỹ, duy trì cấu trúc da khỏe bền.
Multi-Vitamin (A, C, E, B5 và nhóm vi chất chống oxy hóa):
Vitamin C: Kích thích tổng hợp collagen mới, làm sáng da và giảm nguy cơ tăng sắc tố.
Vitamin A: Thúc đẩy quá trình sừng hóa bình thường, làm mịn bề mặt da thô ráp.
Vitamin E, B5: Bảo vệ lipid màng tế bào khỏi gốc tự do, giảm stress oxy hóa sau trị liệu, làm dịu phản ứng viêm nhẹ.
Hình thức sử dụng linh hoạt:
>> Sử dụng đơn lẻ:
Dưỡng chuyên sâu phục hồi tại nhà, duy trì độ ẩm và củng cố nền da sau trị liệu thẩm mỹ.
>> Kết hợp trong quy trình điều trị chuyên nghiệp:
Phi kim (microneedling): Tạo đường dẫn siêu vi điểm để HA và acid amin thẩm thấu sâu, đẩy nhanh tái tạo mô.
Điện di lạnh (electroporation): Tăng cường hấp thu hoạt chất mà không gây xâm lấn, phù hợp da nhạy cảm.
Mesotherapy không kim: Áp dụng công nghệ sóng điện từ tần số thấp đưa dưỡng chất vào lớp trung bì.
Tính an toàn vượt trội:
Nhờ công thức dịu nhẹ, không chứa cồn khô, paraben hay hương liệu tổng hợp, sản phẩm giảm tối đa nguy cơ kích ứng, phù hợp cả làn da nhạy cảm, đang viêm nhẹ hoặc dễ đỏ rát sau peel – laser.
>> Hiệu quả tổng hợp: Không chỉ cấp ẩm – mà là hồi sinh nền da
>> Sau một liệu trình sử dụng Ha-Pcell (3–6 tuần), người dùng có thể ghi nhận các cải thiện đa chiều:
✅ Da căng mướt, đủ ẩm rõ rệt, giảm khô ráp bong tróc
✅ Độ đàn hồi và mật độ da tăng rõ rệt, bề mặt da săn chắc, ít nhăn
✅ Sắc tố da đồng đều hơn, da sáng, mịn màng và tươi khỏe
✅ Cải thiện các nếp nhăn nhỏ vùng khóe miệng, đuôi mắt
✅ Hàng rào bảo vệ da khỏe mạnh hơn, giảm nhạy cảm, ít kích ứng trước các yếu tố môi trường
Sản phẩm không chỉ dừng lại ở chức năng cấp ẩm tức thời, mà còn là một liệu pháp tái cấu trúc nền da toàn diện – nuôi dưỡng sức khỏe làn da từ tầng sâu
Sự kết hợp giữa HA – amino acid – vitamin chống oxy hóa không chỉ mang lại hiệu quả làm đẹp tức thì mà còn giúp xây dựng một “nền da khỏe” – yếu tố cốt lõi cho mọi bước chăm sóc da tiếp theo. Với Ha-Pcell, phục hồi da không còn là lựa chọn sau tổn thương, mà trở thành chiến lược chủ động để chống lão hóa, kéo dài thanh xuân cho làn da.
—-
TÀI LIỆU THAM KHẢO
American Academy of Aesthetic Medicine. What Is Aesthetic Medicine? Available online: https://www.aaamed.org/aesthetic-medicine.php (accessed on 19 May 2023).
Csekes, E.; Račková, L. Skin aging, cellular senescence and natural polyphenols. Int. J. Mol. Sci. 2021, 22, 12641. [Google Scholar] [CrossRef] [PubMed]
Chaudhary, M.; Khan, A.; Gupta, M. Skin ageing: Pathophysiology and current market treatment approaches. Curr. Aging Sci. 2020, 13, 22–30. [Google Scholar] [CrossRef] [PubMed]
Zouboulis, C.C.; Ganceviciene, R.; Liakou, A.I.; Theodoridis, A.; Elewa, R.; Makrantonaki, E. Aesthetic aspect of skin aging, prevention, and local treatment. Clin. Dermatol. 2019, 37, 365–372. [Google Scholar] [CrossRef] [PubMed]
Bonté, F.; Girard, D.; Archambault, J.C.; Desmoulière, A. Skin changes during ageing. Subcell. Biochem. 2019, 91, 249–280. [Google Scholar] [PubMed]
Bifarini, B.; Gori, F.; Russo, D.; Mammucari, M.; Maggiori, E.; Di Marzo, R.; Migliore, A.; Massafra, U.; Ronconi, G.; Ferrara, P.E.; et al. Intradermal therapy (mesotherapy): The lower the better. Clin. Ter. 2022, 173, 79–83. [Google Scholar] [PubMed]
Mammucari, M.; Maggiori, E.; Russo, D.; Giorgio, C.; Ronconi, G.; Ferrara, P.E.; Canzona, F.; Antonaci, L.; Violo, B.; Vellucci, R.; et al. Mesotherapy: From Historical Notes to Scientific Evidence and Future Prospects. Sci. World J. 2020, 2020, 3542848. [Google Scholar] [CrossRef]
Wu, G.T.; Kam, J.; Bloom, J.D. Hyaluronic Acid Basics and Rheology. Clin. Plast. Surg. 2023, 50, 391–398. [Google Scholar] [CrossRef]
Bravo, B.; Correia, P.; Gonçalves Junior, J.E.; Sant’Anna, B.; Kerob, D. Benefits of topical hyaluronic acid for skin quality and signs of skin aging: From literature review to clinical evidence. Dermatol. Ther. 2022, 35, e15903. [Google Scholar] [CrossRef]
Duteil, L.; Queille-Roussel, C.; Issa, H.; Sukmansaya, N.; Murray, J.; Fanian, F. The Effects of a Non-crossed-linked Hyaluronic Acid Gel on the Aging Signs of the Face versus Normal Saline: A Randomized, Double-blind, Placebo-controlled, Split-faced Study. J. Clin. Aesthet. Dermatol. 2023, 16, 29–36. [Google Scholar]
Ghatge, A.S.; Ghatge, S.B. The Effectiveness of Injectable Hyaluronic Acid in the Improvement of the Facial Skin Quality: A Systematic Review. Clin. Cosmet. Investig. Dermatol. 2023, 16, 891–899. [Google Scholar] [CrossRef]
Iranmanesh, B.; Khalili, M.; Mohammadi, S.; Amiri, R.; Aflatoonian, M. Employing hyaluronic acid-based mesotherapy for facial rejuvenation. J. Cosmet. Dermatol. 2022, 21, 6605–6618. [Google Scholar] [CrossRef]
Urdiales-Gálvez, F.; Martín-Sánchez, S.; Maíz-Jiménez, M.; Castellano-Miralla, A.; Lionetti-Leone, L. Concomitant Use of Hyaluronic Acid and Laser in Facial Rejuvenation. Aesthetic Plast. Surg. 2019, 43, 1061–1070. [Google Scholar] [CrossRef]
Bukhari, S.N.A.; Roswandi, N.L.; Waqas, M.; Habib, H.; Hussain, F.; Khan, S.; Sohail, M.; Ramli, N.A.; Thu, H.E.; Hussain, Z. Hyaluronic acid, a promising skin rejuvenating biomedicine: A review of recent updates and pre-clinical and clinical investigations on cosmetic and nutricosmetic effects. Int. J. Biol. Macromol. 2018, 120, 1682–1695. [Google Scholar] [CrossRef]
Litwiniuk, M.; Krejner, A.; Speyrer, M.S.; Gauto, A.R.; Grzela, T. Hyaluronic Acid in Inflammation and Tissue Regeneration. Wounds 2016, 28, 78–88. [Google Scholar]
Berdiaki, A.; Neagu, M.; Spyridaki, I.; Kuskov, A.; Perez, S.; Nikitovic, D. Hyaluronan and Reactive Oxygen Species Signaling-Novel Cues from the Matrix? Antioxidants 2023, 12, 824. [Google Scholar] [CrossRef]
Soltés, L.; Mendichi, R.; Kogan, G.; Schiller, J.; Stankovska, M.; Arnhold, J. Degradative action of reactive oxygen species on hyaluronan. Biomacromolecules 2006, 7, 659–668. [Google Scholar] [CrossRef]
Misra, S.; Hascall, V.C.; Markwald, R.R.; Ghatak, S. Interactions between Hyaluronan and Its Receptors (CD44, RHAMM) Regulate the Activities of Inflammation and Cancer. Front. Immunol. 2015, 6, 201. [Google Scholar] [CrossRef]
Balogh, G.T.; Illés, J.; Székely, Z.; Forrai, E.; Gere, A. Effect of different metal ions on the oxidative damage and antioxidant capacity of hyaluronic acid. Arch. Biochem. Biophys. 2003, 410, 76–82. [Google Scholar] [CrossRef]
Abe, C.; Miyazawa, T.; Miyazawa, T. Current Use of Fenton Reaction in Drugs and Food. Molecules 2022, 27, 5451. [Google Scholar] [CrossRef]
Ninh Pham, A.; Xing, G.; Miller, C.J.; Waite, T.D. Fenton-like copper redox chemistry revisited: Hydrogen peroxide and superoxide mediation of copper-catalyzed oxidant production. J. Catalysis 2013, 301, 54–64. [Google Scholar] [CrossRef]
Svolacchia, F.; Svolacchia, L.; Marchetti, M.; Prisco, C.; Inchingolo, F.; Amuso, D.; Giuzio, F.; Scarano, A. Evaluation of the efficacy and safety of hyaluronic acid and supplemented with amino acids, and glutathione or colin, for the prevention and treatment of wrinkles on the face, neck, décolleté and hands. Eur. Rev. Med. Pharmacol. Sci. 2023, 27, 99–108. [Google Scholar] [PubMed]
Wang, S.; Niu, H.; Liu, Y.; Tan, Y.; Gao, H.; Ren, S.; Wang, L. Clinical Efficacy and Safety of Non-Cross-Linked Hyaluronic Acid Combined with L-carnosine for Horizontal Neck Wrinkles Treatment. Aesthetic Plast. Surg. 2021, 45, 2912–2917. [Google Scholar] [CrossRef] [PubMed]
Scarano, A.; Sbarbati, A.; Deriu, F.; Inchingolo, F.; Amuso, D.; Iorio, E.L.; Amore, R.; Mortellaro, C.; Bartolini, S.; Greco Lucchina, A.; et al. Clinical evaluation of efficacy and tolerance of a skin reconditioning compound for anti-aging. J. Biol. Regul. Homeost. Agents 2021, 35, 217–226. [Google Scholar] [PubMed]
Sparavigna, A.; Tenconi, B.; De Ponti, I. Antiaging, photoprotective, and brightening activity in biorevitalization: A new solution for aging skin. Clin. Cosmet. Investig. Dermatol. 2015, 8, 57–65. [Google Scholar] [CrossRef] [PubMed]
Amin, S.P.; Phelps, R.G.; Goldberg, D.J. Mesotherapy for facial skin rejuvenation: A clinical, histologic, and electron microscopic evaluation. Dermatol. Surg. 2006, 32, 1467–1472. [Google Scholar] [CrossRef] [PubMed]
EN ISO 14155:2020; Clinical Investigation of Medical Devices for Human Subjects—Good Clinical Practice. International Organization for Standardization: Geneva, Switzerland, 2020.
Clarys, P.; Clijsen, R.; Taeymans, J.; Barel, A.O. Hydration measurements of the stratum corneum: Comparison between the capacitance method (digital version of the Corneometer CM 825®) and the impedance method (Skicon-200EX®). Skin Res. Technol. 2012, 18, 316–323. [Google Scholar] [CrossRef] [PubMed]
O’goshi, K.; Serup, J. Inter-instrumental variation of skin capacitance measured with the Corneometer. Skin Res. Technol. 2005, 11, 107–109. [Google Scholar] [CrossRef] [PubMed]
Blichmann, C.W.; Serup, J. Assessment of skin moisture. Measurement of electrical conductance, capacitance and transepidermal water loss. Acta Derm. Venereol. 1988, 68, 284–290. [Google Scholar] [PubMed]
Luebberding, S.; Krueger, N.; Kerscher, M. Mechanical properties of human skin in vivo: A comparative evaluation in 300 men and women. Skin Res. Technol. 2014, 20, 127–135. [Google Scholar] [CrossRef]
Krueger, N.; Luebberding, S.; Oltmer, M.; Streker, M.; Kerscher, M. Age-related changes in skin mechanical properties: A quantitative evaluation of 120 female subjects. Skin Res. Technol. 2011, 17, 141–148. [Google Scholar] [CrossRef]
Dobrev, H. Application of Cutometer area parameters for the study of human skin fatigue. Skin Res. Technol. 2005, 11, 120–122. [Google Scholar] [CrossRef] [PubMed]
Phillips, J.; Reynolds, K.J.; Gordon, S.J. Dermal thickness and echogenicity using DermaScan C high frequency ultrasound: Methodology and reliability testing in people with and without primary lymphoedema. Skin Res. Technol. 2020, 26, 813–823. [Google Scholar] [CrossRef] [PubMed]
Van den Kerckhove, E.; Staes, F.; Flour, M.; Stappaerts, K.; Boeckx, W. Reproducibility of repeated measurements on post-burn scars with Dermascan C. Skin Res. Technol. 2003, 9, 81–84. [Google Scholar] [CrossRef] [PubMed]
Olsen, L.O.; Takiwaki, H.; Serup, J. High-frequency ultrasound characterization of normal skin. Skin thickness and echographic density of 22 anatomical sites. Skin Res. Technol. 1995, 1, 74–80. [Google Scholar] [CrossRef] [PubMed]
Mosdósi, B.; Bölcskei, K.; Helyes, Z. Impairment of microcirculation and vascular responsiveness in adolescents with primary Raynaud phenomenon. Pediatr. Rheumatol. Online J. 2018, 16, 20. [Google Scholar] [CrossRef] [PubMed]
Choi, C.M.; Bennett, R.G. Laser Dopplers to determine cutaneous blood flow. Dermatol. Surg. 2003, 29, 272–280. [Google Scholar]
Bleve, M.; Capra, P.; Pavanetto, F.; Perugini, P. Ultrasound and 3D Skin Imaging: Methods to Evaluate Efficacy of Striae Distensae Treatment. Dermatol. Res. Pract. 2012, 2012, 673706. [Google Scholar] [CrossRef] [PubMed]
Maidhof, R.; Knapp, E.; Liebel, F.; Fair, M.; Rubinson, E.H. Technical approaches to select high-performance instant skin smoothing formulations: Correlation of in vitro and in vivo assessment methods. Skin Res. Technol. 2019, 25, 606–611. [Google Scholar] [CrossRef] [PubMed]
Uhoda, E.; Piérard-Franchimont, C.; Petit, L.; Piérard, G. Skin weathering and ashiness in black Africans. Eur. J. Dermatol. 2003, 13, 574–578. [Google Scholar]
Hourblin, V.; Nouveau, S.; Roy, N.; de Lacharrière, O. Skin complexion and pigmentary disorders in facial skin of 1204 women in 4 Indian cities. Indian J. Dermatol. Venereol. Leprol. 2014, 80, 395–401. [Google Scholar] [CrossRef]
Campiche, R.; Trevisan, S.; Séroul, P.; Rawlings, A.V.; Adnet, C.; Imfeld, D.; Voegeli, R. Appearance of aging signs in different pigmented facial skin by a novel imaging system. J. Cosmet. Dermatol. 2019, 18, 614–627. [Google Scholar] [CrossRef] [PubMed]
Savoia, A.; Vannini, F.; Baldi, A. Radiofrequency waves with filling and peeling substances: An innovative minimally invasive technique for facial rejuvenation. Dermatol. Ther. 2011, 1, 2–10. [Google Scholar] [CrossRef] [PubMed]
Westermann, T.V.A.; Viana, V.R.; Berto Junior, C.; Detoni da Silva, C.B.; Carvalho, E.L.S.; Pupe, C.G. Measurement of skin hydration with a portable device (SkinUp® Beauty Device) and comparison with the Corneometer®. Skin Res. Technol. 2020, 26, 571–576. [Google Scholar] [CrossRef] [PubMed]
Constantin, M.M.; Poenaru, E.; Poenaru, C.; Constantin, T. Skin Hydration Assessment through Modern Non-Invasive Bioengineering Technologies. Maedica 2014, 9, 33–38. [Google Scholar] [PubMed]
Heinrich, U.; Koop, U.; Leneveu-Duchemin, M.C.; Osterrieder, K.; Bielfeldt, S.; Chkarnat, C.; Degwert, J.; Häntschel, D.; Jaspers, S.; Nissen, H.P.; et al. Multicentre comparison of skin hydration in terms of physical-, physiological- and product-dependent parameters by the capacitive method (Corneometer CM 825). Int. J. Cosmet. Sci. 2003, 25, 45–53. [Google Scholar] [CrossRef] [PubMed]
Constantin, M.-M.; Bucur, S.; Serban, E.-D.; Olteanu, R.; Bratu, O.G.; Constantin, T. Measurement of skin viscoelasticity: A non-invasive approach in allergic contact dermatitis. Exp. Ther. Med. 2020, 20, 184. [Google Scholar] [CrossRef] [PubMed]
Granger, C.; Aladren, S.; Delgado, J.; Garre, A.; Trullas, C.; Gilaberte, Y. Prospective Evaluation of the Efficacy of a Food Supplement in Increasing Photoprotection and Improving Selective Markers Related to Skin Photo-Ageing. Dermatol. Ther. 2020, 10, 163–178. [Google Scholar] [CrossRef] [PubMed]
Abbas, D.B.; Lavin, C.V.; Fahy, E.J.; Griffin, M.; Guardino, N.; King, M.; Chen, K.; Lorenz, P.H.; Gurtner, G.C.; Longaker, M.T.; et al. Standardizing Dimensionless Cutometer Parameters to Determine In Vivo Elasticity of Human Skin. Adv. Wound Care 2022, 11, 297–310. [Google Scholar] [CrossRef] [PubMed]
Kawałkiewicz, W.; Matthews-Kozanecka, M.; Janus-Kubiak, M.; Kubisz, L.; Hojan-Jezierska, D. Instrumental diagnosis of facial skin-A necessity or a pretreatment recommendation in esthetic medicine. J. Cosmet. Dermatol. 2021, 20, 875–883. [Google Scholar] [CrossRef]
Waszczykowska, A.; Goś, R.; Waszczykowska, E.; Dziankowska-Bartkowiak, B.; Jurowski, P. Assessment of skin microcirculation by laser Doppler flowmetry in systemic sclerosis patients. Postepy Dermatol. Alergol. 2014, 31, 6–11. [Google Scholar] [CrossRef]
Luck, J.C.; Kunselman, A.R.; Herr, M.D.; Blaha, C.A.; Sinoway, L.I.; Cui, J. Multiple Laser Doppler Flowmetry Probes Increase the Reproducibility of Skin Blood Flow Measurements. Front. Physiol. 2022, 13, 876633. [Google Scholar] [CrossRef] [PubMed]
Filina, M.A.; Potapova, E.V.; Makovik, I.N.; Zharkih, E.V.; Dremin, V.V.; Zherebtsov, E.A.; Dunaev, A.V.; Sidorov, V.V.; Krupatkin, A.I.; Alimicheva, E.A.; et al. Functional Changes in Blood Microcirculation in the Skin of the Foot during Heating Tests in Patients with Diabetes Mellitus. Hum. Physiol. 2017, 43, 693–699. [Google Scholar] [CrossRef]
Orbegozo, D.; Mongkolpun, W.; Stringari, G.; Markou, N.; Creteur, J.; Vincent, J.L.; De Backer, D. Skin microcirculatory reactivity assessed using a thermal challenge is decreased in patients with circulatory shock and associated with outcome. Ann. Intensive Care 2018, 8, 60. [Google Scholar] [CrossRef] [PubMed]
Carlos da Silva, G.; Barbosa, M.B.; Júnior, F.B.C.; Moreira, P.L.; Werka, R.; Martin, A.A. Detection of skin wrinkles and quantification of roughness using a novel image processing technique from a dermatoscope device. Skin Res. Technol. 2023, 29, e13335. [Google Scholar] [CrossRef] [PubMed]
Baek, J.H.; Yoo, M.A.; Koh, J.S.; Borkow, G. Reduction of facial wrinkles depth by sleeping on copper oxide-containing pillowcases: A double blind, placebo controlled, parallel, randomized clinical study. J. Cosmet. Dermatol. 2012, 11, 193–200. [Google Scholar] [CrossRef]
Fujimura, T.; Haketa, K.; Hotta, M.; Kitahara, T. Global and systematic demonstration for the practical usage of a direct in vivo measurement system to evaluate wrinkles. Int. J. Cosmet. Sci. 2007, 29, 423–436. [Google Scholar] [CrossRef] [PubMed]
Ablon, G. Safety and Effectiveness of an Automated Microneedling Device in Improving the Signs of Aging Skin. J. Clin. Aesthet. Dermatol. 2018, 11, 29–34. [Google Scholar] [PubMed]
Jaspers, S.; Hopermann, H.; Sauermann, G.; Hoppe, U.; Lunderstadp, R.; Ennen, J. Rapid in vivo measurement of the topography of humanskin by active image triangulation using a digitalmicromirror device. Skin. Res.Technol. 1999, 5, 195–207. [Google Scholar] [CrossRef]
Ly, B.C.K.; Dyer, E.B.; Feig, J.L.; Chien, A.L.; Del Bino, S. Research Techniques Made Simple: Cutaneous Colorimetry: A Reliable Technique for Objective Skin Color Measurement. J. Investig. Dermatol. 2020, 140, 3–12.e1. [Google Scholar] [CrossRef]
Weatherall, I.L.; Coombs, B.D. Skin color measurements in terms of CIELAB color space values. J. Investig. Dermatol. 1992, 99, 468–473. [Google Scholar] [CrossRef]
Gordon, R.A.; Branigan, A.R.; Khan, M.A.; Nunez, J.G. Measuring Skin Color: Consistency, Comparability, and Meaningfulness of Rating Scale Scores and Handheld Device Readings. J. Survey Statistics Methodol. 2022, 10, 337–364. [Google Scholar] [CrossRef]
Kikuchi, K.; Masuda, Y.; Yamashita, T.; Kawai, E.; Hirao, T. Image analysis of skin color heterogeneity focusing on skin chromophores and the age-related changes in facial skin. Skin Res. Technol. 2015, 21, 175–813. [Google Scholar] [CrossRef] [PubMed]
Papakonstantinou, E.; Roth, M.; Karakiulakis, G. Hyaluronic acid: A key molecule in skin aging. Dermato-Endocrinology 2012, 4, 253–258. [Google Scholar] [CrossRef] [PubMed]
Vasvani, S.; Kulkarni, P.; Rawtani, D. Hyaluronic acid: A review on its biology, aspects of drug delivery, route of administrations and a special emphasis on its approved marketed products and recent clinical studies. Int. J. Biol. Macromol. 2020, 151, 1012–1029. [Google Scholar] [CrossRef] [PubMed]
Lennon, F.E.; Singleton, P.A. Hyaluronan regulation of vascular integrity. Am. J. Cardiovasc. Dis. 2011, 1, 200–213. [Google Scholar] [PubMed]
Schmidt, J.; Pilbauerova, N.; Soukup, T.; Suchankova-Kleplova, T.; Suchanek, J. Low Molecular Weight Hyaluronic Acid Effect on Dental Pulp Stem Cells In Vitro. Biomolecules 2020, 11, 22. [Google Scholar] [CrossRef] [PubMed]
Snetkov, P.; Zakharova, K.; Morozkina, S.; Olekhnovich, R.; Uspenskaya, M. Hyaluronic acid: The influence of molecular weight on structural, physical, physico- chemical, and degradable properties of biopoly-mer. Polymers 2020, 12, 1800. [Google Scholar] [CrossRef] [PubMed]
Witting, M.; Boreham, A.; Brodwolf, R.; Vávrová, K.; Alexiev, U.; Friess, W.; Hedtrich, S. Interactions of hyaluronic Acid with the skin and implications for the dermal delivery of biomacromolecules. Mol. Pharm. 2015, 12, 1391–1401. [Google Scholar] [CrossRef]
Nakamura, M.; Hikida, M.; Nakano, T.; Ito, S.; Hamano, T.; Kinoshita, S. Characterization of water retentive properties of hyaluronan. Cornea 1993, 12, 433–436. [Google Scholar] [CrossRef]
Siquier-Dameto, G.; Boisnic, S.; Boadas-Vaello, P.; Verdú, E. Anti-Aging and Depigmentation Effect of a Hyaluronic Acid Mechanically Stabilized Complex on Human Skin Explants. Polymers 2023, 15, 2438. [Google Scholar] [CrossRef]
Seok, J.; Hong, J.Y.; Choi, S.Y.; Park, K.Y.; Kim, B.J. A potential relationship between skin hydration and stamp-type microneedle intradermal hyaluronic acid injection in middle-aged male face. J. Cosmet. Dermatol. 2016, 15, 578–582. [Google Scholar] [CrossRef] [PubMed]
Roh, N.K.; Kim, M.J.; Lee, Y.W.; Choe, Y.B.; Ahn, K.J. A Split-Face Study of the Effects of a Stabilized Hyaluronic Acid-Based Gel of Nonanimal Origin for Facial Skin Rejuvenation Using a Stamp-Type Multineedle Injector: A Randomized Clinical Trial. Plast. Reconstr. Surg. 2016, 137, 809–816. [Google Scholar] [CrossRef]
Choi, S.Y.; Ko, E.J.; Yoo, K.H.; Han, H.S.; Kim, B.J. Effects of hyaluronic acid injected using the mesogun injector with stamp-type microneedle on skin hydration. Dermatol. Ther. 2020, 33, e13963. [Google Scholar] [CrossRef]
Uchegbulam, I.; Danby, S.G.; Lewis, R.; Carré, M.J.; Maiti, R. Effect of seasonal change on the biomechanical and physical properties of the human skin. J. Mech. Behav. Biomed. Mater. 2022, 127, 105058. [Google Scholar] [CrossRef] [PubMed]
Kapoor, S.; Saraf, S. Assessment of viscoelasticity and hydration effect of herbal moisturizers using bioengineering techniques. Pharmacogn. Mag. 2010, 6, 298–304. [Google Scholar] [CrossRef]
Ahshawat, M.S.; Saraf, S.; Saraf, S. Preparation and characterization of herbal creams for improvement of skin viscoelastic properties. Int. J. Cosmet. Sci. 2008, 30, 183–193. [Google Scholar] [CrossRef] [PubMed]
Nishimura, N.; Inoue, S.; Yokoyama, K.; Iwase, S. Effect of spraying of fine water particles on facial skin moisture and viscoelasticity in adult women. Skin Res. Technol. 2019, 25, 294–298. [Google Scholar] [CrossRef]
O’Brien, M.E.; Chandra, D.; Wilson, R.C.; Karoleski, C.M.; Fuhrman, C.R.; Leader, J.K.; Pu, J.; Zhang, Y.; Morris, A.; Nouraie, S.; et al. Loss of skin elasticity is associated with pulmonary emphysema, biomarkers of inflammation, and matrix metalloproteinase activity in smokers. Respir. Res. 2019, 20, 128. [Google Scholar] [CrossRef]
Salminen, A.; Kaarniranta, K.; Kauppinen, A. Photoaging: UV radiation-induced inflammation and immunosuppression accelerate the aging process in the skin. Inflamm. Res. 2022, 71, 817–831. [Google Scholar] [CrossRef]
Habig, J.; Vocks, E.; Kautzky, F.; Ring, J. Biophysical characteristics of healthy skin and nonlesional skin in atopic dermatitis: Short-term effects of ultraviolet A and B irradiation. Skin. Pharmacol. Appl. Skin. Physiol. 2000, 13, 174–181. [Google Scholar] [CrossRef]
Masaki, H. Role of antioxidants in the skin: Anti-aging effects. J. Dermatol. Sci. 2010, 58, 85–90. [Google Scholar] [CrossRef] [PubMed]
Ansary, T.M.; Hossain, M.R.; Kamiya, K.; Komine, M.; Ohtsuki, M. Inflammatory Molecules Associated with Ultraviolet Radiation-Mediated Skin Aging. Int. J. Mol. Sci. 2021, 22, 3974. [Google Scholar] [CrossRef] [PubMed]
Jakubczyk, K.; Dec, K.; Kałduńska, J.; Kawczuga, D.; Kochman, J.; Janda, K. Reactive oxygen species—Sources, functions, oxidative damage. Pol. Merkur. Lekarski 2020, 48, 124–127. [Google Scholar] [PubMed]
Hayashi, A.; Ryu, A.; Suzuki, T.; Kawada, A.; Tajima, S. In vitro degradation of tropoelastin by reactive oxygen species. Arch. Dermatol. Res. 1998, 290, 497–500. [Google Scholar] [CrossRef] [PubMed]
Akhtar, K.; Broekelmann, T.J.; Miao, M.; Keeley, F.W.; Starcher, B.C.; Pierce, R.A.; Mecham, R.P.; Adair-Kirk, T.L. Oxidative and nitrosative modifications of tropoelastin prevent elastic fiber assembly in vitro. J. Biol. Chem. 2010, 285, 37396–37404. [Google Scholar] [CrossRef] [PubMed]
Yun, S.P.; Lee, S.J.; Oh, S.Y.; Jung, Y.H.; Ryu, J.M.; Suh, H.N.; Kim, M.O.; Oh, K.B.; Han, H.J. Reactive oxygen species induce MMP12-dependent degradation of collagen 5 and fibronectin to promote the motility of human umbilical cord-derived mesenchymal stem cells. Br. J. Pharmacol. 2014, 171, 3283–3897. [Google Scholar] [CrossRef] [PubMed]
Kawaguchi, Y.; Tanaka, H.; Okada, T.; Konishi, H.; Takahashi, M.; Ito, M.; Asai, J. The effects of ultraviolet A and reactive oxygen species on the mRNA expression of 72-kDa type IV collagenase and its tissue inhibitor in cultured human dermal fibroblasts. Arch. Dermatol. Res. 1996, 288, 39–44. [Google Scholar] [CrossRef] [PubMed]
Zaw, K.K.; Yokoyama, Y.; Abe, M.; Ishikawa, O. Catalase restores the altered mRNA expression of collagen and matrix metalloproteinases by dermal fibroblasts exposed to reactive oxygen species. Eur. J. Dermatol. 2006, 16, 375–379. [Google Scholar]
Tanaka, H.; Okada, T.; Konishi, H.; Tsuji, T. The effect of reactive oxygen species on the biosynthesis of collagen and glycosaminoglycans in cultured human dermal fibroblasts. Arch. Dermatol. Res. 1993, 285, 352–355. [Google Scholar] [CrossRef]
Wang, K.; Jiang, H.; Li, W.; Qiang, M.; Dong, T.; Li, H. Role of Vitamin C in Skin Diseases. Front. Physiol. 2018, 9, 819. [Google Scholar] [CrossRef]
Catani, M.V.; Savini, I.; Rossi, A.; Melino, G.; Avigliano, L. Biological role of vitamin C in keratinocytes. Nutr. Rev. 2005, 63, 81–90. [Google Scholar] [CrossRef] [PubMed]
Rahman, S.; Bhatia, K.; Khan, A.Q.; Kaur, M.; Ahmad, F.; Rashid, H.; Athar, M.; Islam, F.; Raisuddin, S. Topically applied vitamin E prevents massive cutaneous inflammatory and oxidative stress responses induced by double application of 12-O-tetradecanoylphorbol-13-acetate (TPA) in mice. Chem.-Biol. Interact. 2008, 172, 195–205. [Google Scholar] [CrossRef] [PubMed]
Camillo, L.; Grossini, E.; Farruggio, S.; Marotta, P.; Gironi, L.C.; Zavattaro, E.; Savoia, P. Alpha-Tocopherol Protects Human Dermal Fibroblasts by Modulating Nitric Oxide Release, Mitochondrial Function, Redox Status, and Inflammation. Skin. Pharmacol. Physiol. 2022, 35, 1–12. [Google Scholar] [CrossRef] [PubMed]
Braga, P.C.; Dal Sasso, M.; Lattuada, N.; Greco, V.; Sibilia, V.; Zucca, E.; Stucchi, L.; Ferro, E.; Ferrucci, F. Antioxidant activity of hyaluronic acid investigated by means of chemiluminescence of equine neutrophil bursts and electron paramagnetic resonance spectroscopy. J. Vet. Pharmacol. Ther. 2015, 38, 48–54. [Google Scholar] [CrossRef] [PubMed]
Bellon, G.; Chaqour, B.; Wegrowski, Y.; Monboisse, J.-C.; Borel, J.-P. Glutamine increases collagen gene transcription in cultured human fibroblasts. Biochim. Biophys. Acta 1995, 1268, 311–323. [Google Scholar] [CrossRef]
Szoka, L.; Karna, E.; Hlebowicz-Sarat, K.; Karaszewski, J.; Palka, J.A. Exogenous proline stimulates type I collagen and HIF-1α expression and the process is attenuated by glutamine in human skin fibroblasts. Mol. Cell. Biochem. 2017, 435, 197–206. [Google Scholar] [CrossRef] [PubMed]
Karna, E.; Szoka, L.; Huynh, T.Y.L.; Palka, J.A. Proline-dependent regulation of collagen metabolism. Cell. Mol. Life Sci. 2020, 77, 1911–1918. [Google Scholar] [CrossRef]
Li, P.; Wu, G. Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth. Amino Acids 2018, 50, 29–38. [Google Scholar] [CrossRef]
Murakami, H.; Shimbo, K.; Inoue, Y.; Takino, Y.; Kobayashi, H. Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice. Amino Acids 2012, 42, 2481–2489. [Google Scholar] [CrossRef]
De Servi, B.; Orlandini, A.; Caviola, E.; Meloni, M. Amino acid and hyaluronic acid mixtures differentially regulate extra cellular matrix genes in cultured human fibroblasts. J. Biol. Regul. Homeost. Agents 2018, 32, 517–527. [Google Scholar]
Tedesco, L.; Rossi, F.; Ruocco, C.; Ragni, M.; Carruba, M.O.; Valerio, A.; Nisoli, E. A designer mixture of six amino acids promotes the extracellular matrix gene expression in cultured human fibroblasts. Biosci. Biotechnol. Biochem. 2022, 86, 1255–1261. [Google Scholar] [CrossRef] [PubMed]
Wang, S.; Yu, R.-X.; Fan, W.; Li, C.-X.; Fei, W.-M.; Li, S.; Zhou, J.; Hu, R.; Liu, M.; Xu, F.; et al. Detection of skin thickness and density in healthy Chinese people by using high-frequency ultrasound. Skin Res. Technol. 2023, 29, e13219. [Google Scholar] [CrossRef] [PubMed]
Firooz, A.; Rajabi-Estarabadi, A.; Zartab, H.; Pazhohi, N.; Fanian, F.; Janani, L. The influence of gender and age on the thickness and echo-density of skin. Skin Res. Technol. 2017, 23, 13–20. [Google Scholar] [CrossRef] [PubMed]
Smalls, L.K.; Randall Wickett, R.; Visscher, M.O. Effect of dermal thickness, tissue composition, and body site on skin biomechanical properties. Skin Res. Technol. 2006, 12, 43–49. [Google Scholar] [CrossRef]
Greco, R.M.; Iocono, J.A.; Ehrlich, H.P. Hyaluronic acid stimulates human fibroblast proliferation within a collagen matrix. J. Cell Physiol. 1998, 177, 465–473. [Google Scholar] [CrossRef]
Mast, B.A.; Diegelmann, R.F.; Krummel, T.M.; Cohen, I.K. Hyaluronic acid modulates proliferation, collagen and protein synthesis of cultured fetal fibroblasts. Matrix 1993, 13, 441–446. [Google Scholar] [CrossRef] [PubMed]
Wang, F.; Garza, L.A.; Kang, S.; Varani, J.; Orringer, J.S.; Fisher, G.J.; Voorhees, J.J. In vivo stimulation of de novo collagen production caused by cross-linked hyaluronic acid dermal filler injections in photodamaged human skin. Arch. Dermatol. 2007, 143, 155–163. [Google Scholar] [CrossRef] [PubMed]
Symonette, C.J.; Kaur Mann, A.; Tan, X.C.; Tolg, C.; Ma, J.; Perera, F.; Yazdani, A.; Turley, E.A. Hyaluronan-phosphatidylethanolamine polymers form pericellular coats on keratinocytes and promote basal keratinocyte proliferation. Biomed. Res. Int. 2014, 2014, 727459. [Google Scholar] [CrossRef] [PubMed]
Pinnell, S.R. Regulation of collagen biosynthesis by ascorbic acid: A review. Yale J. Biol. Med. 1985, 58, 553–559. [Google Scholar]
Pinnell, S.R.; Murad, S.; Darr, D. Induction of collagen synthesis by ascorbic acid: A possible mechanism. Arch. Dermatol. 1987, 123, 1684–1686. [Google Scholar] [CrossRef]
Boo, Y.C. Ascorbic Acid (Vitamin C) as a Cosmeceutical to Increase Dermal Collagen for Skin Antiaging Purposes: Emerging Combination Therapies. Antioxidants 2022, 11, 1663. [Google Scholar] [CrossRef] [PubMed]
Horinouchi, C.D.S.; Oostendorp, C.; Schade, D.; van Kuppevelt, T.H.; Daamen, W.F. Growth factor mimetics for skin regeneration: In vitro profiling of primary human fibroblasts and keratinocytes. Arch. Pharm. 2021, 354, e2100082. [Google Scholar] [CrossRef] [PubMed]
Amano, S. Characterization and mechanisms of photoageing-related changes in skin. Damages of basement membrane and dermal structures. Exp. Dermatol. 2016, 25, 14–19. [Google Scholar] [CrossRef] [PubMed]
Ciccone, V.; Zazzetta, M.; Morbidelli, L. Comparison of the Effect of Two Hyaluronic Acid Preparations on Fibroblast and Endothelial Cell Functions Related to Angiogenesis. Cells 2019, 8, 1479. [Google Scholar] [CrossRef] [PubMed]
Tur, E.; Tur, M.; Maibach, H.I.; Guy, R.H. Basal perfusion of the cutaneous microcirculation: Measurements as a function of anatomic position. J. Investig. Dermatol. 1983, 81, 442–446. [Google Scholar] [CrossRef]
Cui, B.; Wang, Y.; Jin, J.; Yang, Z.; Guo, R.; Li, X.; Yang, L.; Li, Z. Resveratrol Treats UVB-Induced Photoaging by Anti-MMP Expression, through Anti-Inflammatory, Antioxidant, and Antiapoptotic Properties, and Treats Photoaging by Upregulating VEGF-B Expression. Oxidative Med. Cell. Longev. 2022, 2022, 6037303. [Google Scholar] [CrossRef] [PubMed]
Yano, K.; Kadoya, K.; Kajiya, K.; Hong, Y.-K.; Detmar, M. Ultraviolet B irradiation of human skin induces an angiogenic switch that is mediated by upregulation of vascular endothelial growth factor and by downregulation of thrombospondin-1. Br. J. Dermatol. 2005, 152, 115–121. [Google Scholar] [CrossRef]
Trompezinski, S.; Pernet, I.; Schmitt, D.; Viac, J. UV radiation and prostaglandin E2 up-regulate vascular endothelial growth factor (VEGF) in cultured human fibroblasts. Inflamm. Res. 2001, 50, 422–427. [Google Scholar] [CrossRef] [PubMed]
Dong, W.; Li, Y.; Li, X.; Hu, M.; Aodengqimuge; Sun, L.; Guo, N.; Yuan, S.; Song, L. p85α mediates NFAT3-dependent VEGF induction in the cellular UVB response. J. Cell Sci. 2013, 126, 1317–1322. [Google Scholar] [CrossRef]
Hirakawa, S.; Fujii, S.; Kajiya, K.; Yano, K.; Detmar, M. Vascular endothelial growth factor promotes sensitivity to ultraviolet B–induced cutaneous photodamage. Blood 2005, 105, 2392–2399. [Google Scholar] [CrossRef]
Blaudschun, R.; Sunderkötter, C.; Brenneisen, P.; Hinrichs, R.; Peters, T.; Schneider, L.; Razi-Wolf, Z.; Hunzelmann, N.; Scharffetter-Kochanek, K. Vascular endothelial growth factor causally contributes to the angiogenic response upon ultraviolet B irradiation in vivo. Br. J. Dermatol. 2002, 146, 581–587. [Google Scholar] [CrossRef] [PubMed]
Sato, M.; Matsumoto, Y.; Morita, H.; Takemura, H.; Shimoi, K.; Amano, I. Effects of vitamin supplementation on microcirculatory disturbance in hemodialysis patients without peripheral arterial disease. Clin. Nephrol. 2003, 60, 28–34. [Google Scholar] [CrossRef] [PubMed]
Dupont, J.J.; Farquhar, W.B.; Townsend, R.R.; Edwards, D.G. Ascorbic acid or L-arginine improves cutaneous microvascular function in chronic kidney disease. J. Appl. Physiol. 2011, 111, 1561–1567. [Google Scholar] [CrossRef] [PubMed]
Houshmand, E.B. Effect of glycolic acid, phytic acid, soothing complex containing Emulsion on Hyperpigmentation and skin luminosity: A clinical evaluation. J. Cosmet. Dermatol. 2021, 20, 776–780. [Google Scholar] [CrossRef] [PubMed]
Baret, M.; Bensimon, N.; Coronel, S.; Ventura, S.; Nicolas-Garcia, S.; Korichi, R.; Gazano, G. Characterization and quantification of the skin radiance through new digital image analysis. Skin Res. Technol. 2006, 12, 254–260. [Google Scholar] [CrossRef] [PubMed]
Petitjean, A.; Sainthillier, J.-M.; Mac-Mary, S.; Muret, P.; Closs, B.; Gharbi, T.; Humbert, P. Skin radiance: How to quantify? Validation of an optical method. Skin Res. Technol. 2007, 13, 2–8. [Google Scholar] [CrossRef] [PubMed]
Gao, Y.; Lin, W.; Zhou, S.; Shi, G.; He, J.; Chen, Y. Treatment of Rosacea using acupuncture for improving the local skin microcirculation: A case report. Medicine 2018, 97, e11931. [Google Scholar] [CrossRef]
Heinrich, U.; Moore, C.E.; De Spirt, S.; Tronnier, H.; Stahl, W. Green tea polyphenols provide photoprotection, increase microcirculation, and modulate skin properties of women. J. Nutr. 2011, 141, 1202–1208. [Google Scholar] [CrossRef]
Visscher, M.O.; Burkes, S.A.; Adams, D.M.; Hammill, A.M.; Wickett, R.R. Infant skin maturation: Preliminary outcomes for color and biomechanical properties. Skin Res. Technol. 2017, 23, 545–551. [Google Scholar] [CrossRef]
de Rigal, J.; Des Mazis, I.; Diridollou, S.; Querleux, B.; Yang, G.; Leroy, F.; Barbosa, V.H. The effect of age on skin color and color heterogeneity in four ethnic groups. Skin Res. Technol. 2010, 16, 168–178. [Google Scholar] [CrossRef]
Chardon, A.; Cretois, I.; Hourseau, C. Skin colour typology and suntanning pathways. Int. J. Cosmet. Sci. 1991, 13, 191–208. [Google Scholar] [CrossRef] [PubMed]
Martin-Langrand, G.; Beaufrère-Seron, B.; Korichi, R.; Neveu, M.; Schnebert, S. Facial and Skin Radiance: New Indexes; IFSCC: New York, NY, USA, 2014. [Google Scholar]
Paganelli, A.; Mandel, V.D.; Pellacani, G.; Rossi, E. Synergic effect of plasma exeresis and non-cross-linked low and high molecular weight hyaluronic acid to improve neck skin laxities. J. Cosmet. Dermatol. 2020, 19, 55–60. [Google Scholar] [CrossRef] [PubMed]
Beer, K.; Biesman, B.; Cox, S.E.; Smith, S.; Picault, L.; Trevidic, P. Efficacy and Safety of Resilient Hyaluronic Acid Fillers Injected with a Cannula: A Randomized, Evaluator-Blinded, Split-Face Controlled Study. Clin. Cosmet. Investig. Dermatol. 2023, 16, 959–972. [Google Scholar] [CrossRef] [PubMed]
Yeh, L.C.; Goldberg, D.J. Twelve-month prospective study of polymethylmethacrylate/collagen dermal filler for volume loss of the dorsal of hands. J. Cosmet. Dermatol. 2020, 19, 2259–2266. [Google Scholar] [CrossRef] [PubMed]
Philipp-Dormston, W.G.; Hilton, S.; Nathan, M. A prospective, open-label, multicenter, observational, postmarket study of the use of a 15 mg/mL hyaluronic acid dermal filler in the lips. J. Cosmet. Dermatol. 2014, 13, 125–134. [Google Scholar] [CrossRef] [PubMed]
Laurino, C.; Palmieri, B.; Coacci, A. Efficacy, Safety, and Tolerance of a New Injection Technique for High- and Low-Molecular-Weight Hyaluronic Acid Hybrid Complexes. Eplasty 2015, 15, e46. [Google Scholar] [PubMed]
Lee, H.; Yoon, K.; Lee, M. Full-face augmentation using Tissuefill mixed with platelet-rich plasma: “Q.O.Fill”. J. Cosmet. Laser Ther. 2019, 21, 166–170. [Google Scholar] [CrossRef] [PubMed]
Hercberg, S.; Ezzedine, K.; Guinot, C.; Preziosi, P.; Galan, P.; Bertrais, S.; Estaquio, C.; Briançon, S.; Favier, A.; Latreille, J.; et al. Antioxidant supplementation increases the risk of skin cancers in women but not in men. J. Nutr. 2007, 137, 2098–2105. [Google Scholar] [CrossRef]
Abroms, L.; Jorgensen, C.M.; Southwell, B.G.; Geller, A.C.; Emmons, K.M. Gender differences in young adults’ beliefs about sunscreen use. Health Educ. Behav. 2003, 30, 29–43. [Google Scholar] [CrossRef]
Junaid, A.B.; Nasreen, R.; Siddiqui, M.J.; Ahmed, W. A Comparative Analysis of Male and Female Consumer Behaviour Factors for their Cosmeceutical Product Types. J. Account. Mark. 2015, 4, 2. [Google Scholar] [CrossRef]
Giacomoni, P.U.; Mammone, T.; Teri, M. Gender-linked differences in human skin. J. Dermatol. Sci. 2009, 55, 144–149. [Google Scholar] [CrossRef] [PubMed]
Tur, E. Physiology of the skin—Differences between women and men. Clin. Dermatol. 1997, 15, 5–16. [Google Scholar] [CrossRef] [PubMed]
Zouboulis, C.C.; Chen, W.-C.; Thornton, M.J.; Qin, K.; Rosenfield, R. Sexual hormones in human skin. Horm. Metab. Res. 2007, 39, 85–95. [Google Scholar] [CrossRef] [PubMed]
Berry, K.; Hallock, K.; Lam, C. Photoaging and Topical Rejuvenation. Clin. Plast. Surg. 2023, 50, 381–390. [Google Scholar] [CrossRef] [PubMed]
Guo, Y.; Wei, W.; Wang, H.; Li, Q.; Wei, C.; Zhang, J.; Jin, P. Effect of a New Hyaluronic Acid Hydrogel Dermal Filler Cross-Linked with Lysine Amino Acid for Skin Augmentation and Rejuvenation. Aesthetic Surg. J. 2023, 44, NP87–NP97. [Google Scholar] [CrossRef]
Poleva, I. Perioral Rejuvenation: Evaluation of Safety and Efficacy of High Molecular Weight Hyaluronic Acid and Amino Acid Treatment. J. Drugs Dermatol. 2022, 21, 968–973. [Google Scholar] [CrossRef]
Savoia, A.; Landi, S.; Baldi, A. A new minimally invasive mesotherapy technique for facial rejuvenation. Dermatol. Ther. 2013, 3, 83–93. [Google Scholar] [CrossRef]


